Compuestos de carbono
La química del carbono es la que estudia sustancias compuestas casi en su totalidad de carbono e hidrógeno, conteniendo también con frecuencias pequeñas proporciones de otros elementos, como el oxígeno, el nitrógeno, el azufre o los halógenos
Características del carbono
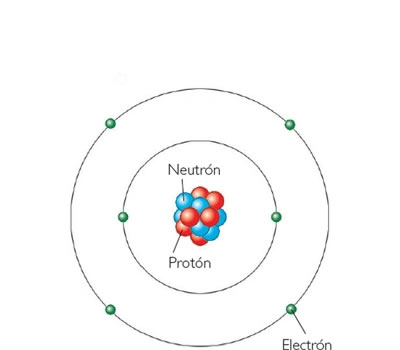
El carbono es un elemento cuyos átomos tienen seis neutrones en su núcleo y seis electrones girando a su alrededor. Existen variós isótopos de este átomo, pero el más abundante es el que tiene seis electrones.
Los electrones del átomo de carbono se disponene en dos niveles con dos electrones en el nivel mas interno y cuatro en el nivel mas externo. Esta configuracion electrónica hace que los átomos de carbono tengan múltiples posibilidades para unirse con otros átomos con enlaces covalentes de manera de completar ocho electrones en el nivel externo.
Como los enlaces covalentes son muy fuertes los compuestos de carbono son muy estables, es por este motivo que este átomo es apto para compuestos muy variados.
Los átomos de carbono, tienen la propiedad de unirse entre sí para formar cadenas rectas y ramificadas que pueden ser abiertas o cerradas, con enlaces simples, dobles y triples. En el caso de los hidrocarburos, los átomos de carbono sólo están unidos a átomos de hidrógeno. Sin embargo, también pueden formar enlaces covalentes con átomos de otros elementos como el oxígeno y el nitrógeno formando parte de un grupo funcional. Dependiendo del arreglo de los átomos los grupos funcionales reciben un nombre.
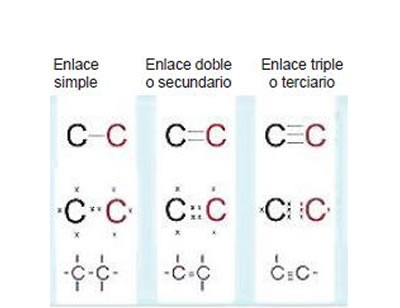
- Enlace simple La manera más sencilla en que se combina el carbono es compartiendo cada uno de sus cuatro electrones con un átomo diferente. En este caso, los enlaces se sitúan apuntando a los cuatro vértices de un tetaedro regular, con el carbono en el baricentro del mismo. Se dice entonces que el carbono actúa de forma tetragonal.
- Enlace doble Otra forma de combinación del carbono es el de compartir dos electrones con un mismo átomo y cada uno de los otros dos electrones con átomos diferentes. En este caso, el enlace doble y los dos sencillos apuntan a los vértices de un triámgulo aproximadamente equilátero una vez mas con el carbono en el baricentro. Se dice que el carbono actua de forma trigonal.
- Enlace triple, Por último, el carbono también puede combinarse compartiendo tres electrones con otro átomo, en la práctica otro de carbono o uno de nitrógeno, y el electrón sobrante con un segundo átomo, generalmente de hidrógeno. En este caso el enlace simple de carbono se situa en linea recta con el enlace triple y se dice que el carbono actua de forma lineal.
Clasificación de los compuestos de carbono
La complejidad de las moléculas de los compuestos orgánicos se debe a que los átomos de carbono se pueden unir entre si formando largas cadenas ramificadas, que son como el esqueleto de las moléculas con cadenas que pueden ser linealesm ramificadas o cíclicas.
El carbono es el componente fundamental de la materia viva, nuestro organismo está formado esencialmente por compuestos de carbono, como las proteinas, los glúcidos, las grasas o las vitaminas. Pero ademas los compuestos de carbono constituyen la mayoria de los materiales que nos rodean como plásticos, maderas, papel, medicinasm fibras sintٞéticas, colorantes, cosmeticoas, inserticidas, el número de los compuestos de carbono es tan elevado que llegan a millones.
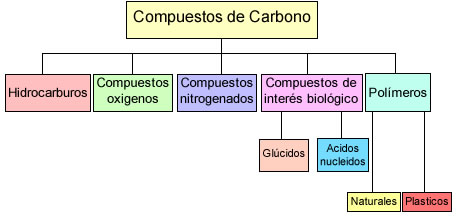
Podemos dividir los compuestos del carbono en:
- Hidrocarburos
- Compuestos oxigenados
- Compuestos nitrogenados
- Compuestos de interés biológico
- Polímeros
Propiedades de compuestos de carbono
- Así debido al carácter covalente de los enlaces, y como no existen fuerzas fuertes entre las moléculas, las temperaturas de fusión y de ebullición son en general bajas. Así los hidrocarburos mas sencillos son los gases o líquidos a temperatura ambiente, pero a medida que aumenta el número de carbono los compuestosque obtenemos son líquidos o sólidos.
- El metano, el etano, el propano y el butano son gases a temperatura ambiente.
- El pentano, el hexano hasta el hidrocarburo que tiene quince carbonos son líquidos a temperatura ambiente. Estos hidocarburos estan presentes en la nafta y el diesel.
- Los hidrocarburos con mas de quince átomos de carbono son sólidos, en este grupo estan las ceras y las parafinas.
- La densidad de los compuestos de carbono es en general menor que las del agua.
- La solubilidad de los hidrocarburos mas sencillos no es soluble al agua, aunque si son solubles en otros disolventes orgánicos como el alcohol.
Propiedades químicas
Los compuestos de carbono no tienen un carácter iónico, por ello, los enlaces tienen un marcado carácter covalente. Los enlaces covalentes son enlaces bastante fuertes y difíciles de romper, es por este motivo que las reacciones en las que intervienen los compuestos de carbono son en general lentas y a menudo necesitan la presencia de catalizadores para que la reacción se produzca a un ritmo aprecieble y en muchos casos a elevadas temperaturas.
Otra propiedad importantísima desde el punto de vista práctico es la capacidad energética de los hidrocarburos. En las reacciones de combustión se genera una gran cantidad de energía y como producto de desecho se obtiene dióxido de carbono y agua, observe algunas reacciones.
 Átomo de Carbono
Átomo de CarbonoEl carbono es un elemento químico de número atómico 6 y símbolo C. Es sólido a temperatura ambiente. Dependiendo de las condiciones de formación, puede encontrarse en la naturaleza en distintas formas alotrópicas, carbono amorfo y cristalino en forma de grafito o diamante. Es el pilar básico de la química orgánica; se conocen cerca de 10 millones de compuestos de carbono, y forma parte de todos los seres vivos conocidos.
 Geometría molecular del carbono
Geometría molecular del carbonoLa hibridación de orbitales nos permite interpretar cómo se orienta una molécula en el espacio, qué ángulo posee entre enlace y enlace, cuál es su polaridad y, por tanto, cómo se comportan ante otras sustancias. El carbono tiene la característica de poder unirse a otros átomos por la atracción electroestática de sus electrones, formando enlaces covalentes simples, dobles y triples.
 Garrafa domiciliaria de 10 kilos de gas butano
Garrafa domiciliaria de 10 kilos de gas butano