Ajuste de ecuaciones químicas
En una reacción química se tiene que cumplir siempre la ley de conservación de la masa, y esto se tiene que reflejar en la ecuación química. Para ello, el número total de átomos de cada elemento que aparecen en los reactivos (izquierda) tiene que ser igual que el número de átomos que intervienen en los productos (derecha)
Ajuste de las ecuaciones químicas
En las ecuaciones químicas aparecen las fórmulas químicas de los reactivos y de los productos, así como su estado de agregación. A veces, al escribir la ecuación química no se cumple que en los productos haya la misma cantidad de átomos que en los reactivos, por lo que debemos ajustar la reacción.
En química, la estequiometría es el cálculo de las relaciones cuantitativas entre reactivos y productos en el transcurso de una reacción química. Estas relaciones se pueden deducir a partir de la teoría atómica, aunque históricamente fueron enunciadas sin hacer referencia a la composición de la materia según distintas leyes y principios
El primero que enunció los principios de la estequiometría fue Jeremias Benjamin Richter , en 1792. Escribió:
La estequiometría es la ciencia que mide las proporciones cuantitativas o relaciones de masa en la que los elementos químicos que están implicados
Para ajustar una ecuación química debemos escribir coeficientes delante de las fórmulas de cada sustancia, a estos números se les denomina coeficientes estequiométricos. El ajuste de la ecuación puede llevarse a cabo por varios procedimientos.
Ajuste de Reacciones Químicas Por Tanteo
En este tipo de ajuste buscamos por tanteo los coeficientes estequiométricos que ajustan la ecuación química. Para simplificar esta operación seguimos unas sencillas pautas.
- Los elementos que aparecen en un sólo reactivo y producto se ajustan primero.
- Los elementos libres se ajustan al final
- El uso de coeficientes fraccionarios puede facilitar el ajuste. Estos coeficientes fraccionarios pueden eliminarse multiplicando toda la ecuación por el denominador común.
Como su propio nombre lo indica, se trata de ensayar coeficientes multiplicadores de los productos y reactivos para que a ambos lados de la flecha haya el mismo tipo y número de átomos.
Estudiamos la reacción química del cinc y el ácido clorhídrico
Zn(s)+ HCl(aq) ->ZnCl2(ag)+ H2 (g)
Comprobamos en la izquierda y en la derecha de la ecuación los átomos que intervienen en cada elemento
- Zn : hay uno en cada miembro de la ecuación está ajustado
- H : hay uno a la izquierda y dos a la derecha, lo mismo ocurre con el Cl Para ajustar la ecuación añadimos un coeficiente 2 al HCl. El H y el Cl quedan ajustados.
Comprobamos la ecuación para asegurarnos de que todos lo elementos están igualados:
Zn(s)+ 2HCl(aq) ->ZnCl2(ag)+ H2 (g)
Es importante que al ajustar una ecuación química no modifiquemos los subíndices de las fórmulas, ya que en ese caso la fórmula no corresponderá a las sustancias presentes en la reacción
Ajuste sistemático
Se escribe la ecuación química y se utilizan coeficientes genéricos para cada una de las sustancias. Los principios de conservación del número de átomos se realiza por por medio de una ecuación algebraica.
Zn(s)+ HCl(aq) ->ZnCl2(ag)+ H2 (g)
Esta reaccióm se ajusta de la siguient manera:
Ecuación con coeficientes genéricos
aZn + bHCl -> c ZnCl2 + d H2
Ecuaciones algebraicas para cada tipo de átomos
- Zn a-> c
- H b -> 2d
- Cl b -> 2c
Se resuelve el sistema de ecuaciones asignando un valor arbitrario a uno de los coeficientes, por ejemplo a=1 .Entonces c=2, B=3 y d=1. Como el coeficiente 1 no se escribe la ecuación ajustada es
Zn(s)+ 2HCl(aq) ->ZnCl2(ag)+ H2 (g)
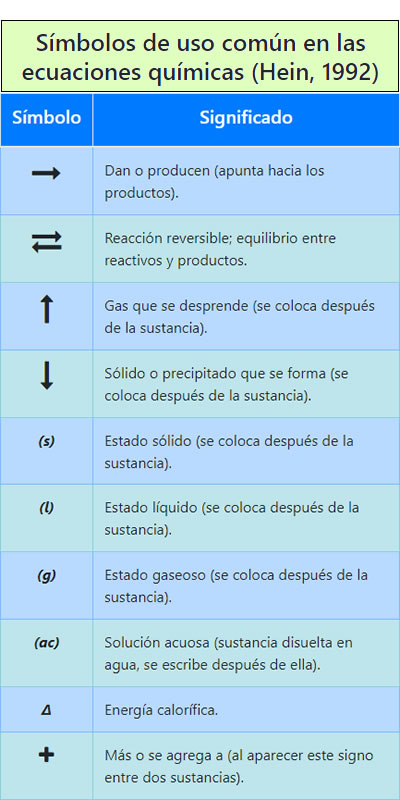 Significado de los símbolos utilizados en la ecuaciones químicas
Significado de los símbolos utilizados en la ecuaciones químicas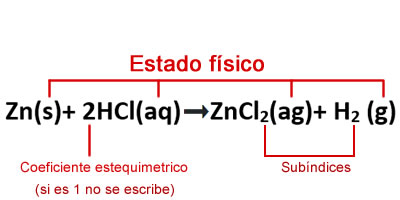 Partes de una fórmula en el ajuste de reacciones químicas por tanteo
Partes de una fórmula en el ajuste de reacciones químicas por tanteo