Enlace covalente
El enlace covalente se suele producir entre átomos de elementos a los que en su última capa les faltán pocos electrones para conseguir los mismos que los de los de la última capa de gas noble más cercano.
Formación de sustancias covalentes
El enlace covalente se basa en la compartición de pares de electrones por dos átomos, cada uno de los cuales aporta uno de los electrones del par. Así los dos alcanzan el número de electrones deseados. Estos enlaces se forman entre átomos iguales o entre átomos que difieren poco en carácter electronegativo, es decir atomos no metalicos. A estas agrupaciones de átomos formadas mediante enlaces covalente se las llama moléculas.
EL flúor, por ejemplo, tiene siete electrones, por tanto, le falta uno para conseguir los mismos que el neón. Si un átomo de flúor cede un electrón a otro átomo del mismo elemento, y, a cambio, el segundo le cede parcialmente otro de los suyos al primero el resultado es que ambos atómos consiguen compartiendo este par de electrones, rodearse de ocho electrones, los mismos que el neón.
Así se forman muchas sustancias puras, unas simples como el hidrógeno (H2), Oxígeno (O2) , nitrógeno (N2) y los cuatro primeros halógenos fluór (F2) , cloro (C2), bromo (Br2) y yodo (I2) y otras compuestas como el agua (H2O) o el metano (CH4).
Los diagramas de Lewis
Los diagramas de Lewis son una manera sencilla de representar a los átomos que se van a enlazar. Consiste en escribir el símbolo del átomo rodeado de tantos puntos como electrones tiene en el último nivel.
Utilizando los diagramas de Lewis, la molécula de H2, la representamos:
H:H o también H->H
Donde (:) reprenta el par de electrones que también puede ser representado por un pequeño trazo rectilínea (->).
En otras moléculas, para conseguir la formulación de la estructura de gas noble(octeto) es necesario que se compartan más de un par de electrones. Así, en el caso de la molécula de O2, dos pares de electrones y tres pares en la molécula de N2. Las moléculas covalentes formadas por átomos diferentes se representan de la misma forma que las formadas por átomos iguales.
Enlace covalente homopolar y heteropolar
Cuando se unen átomos iguales por medio de un enlace covalente, tal como sucede en los casos de H2, O2, Cl2, etc, los electrones compartidos estan simétricamente situados respecto de ambos átomos y la distribución de las cargas eléctricas negativas es uniforme dentro de la molécula, a este enlace se le llama enlace covalente homopolar.
En los casos del amoniaco NH2, agua H2O, etc, la distribución de las cargas elécticas negativas no es simétrica hay una mayor densidad de carga negativa en la proximidad del elemento más electronegativo, mientras que en la proximidad del otro hay una mayor densidad de carga positiva. Como consecuencia, se forma una molécula con dos polos elٞéctricos, uno positivo y el otro negativo., moléculca que recibe el nombre de dipolo. Decimos que una molécula tiene un enlace covalente heteropolar, o un enlace covalente polar, cuando forma un dipolo.
Este es el caso del cloruro de hidrógeno HCl, gas que disuelto en agua se llama ácido clorhídrico. El cloro en un átomo más elecronegativo que el hidrógeno, tiene mٞás tendencia a atraer el par de electrones de enlace., lo que provoca una cierta polaridad en la molécula, un polo positivo en el átomo de hidrógeno y uno negativo en el átomo de cloro.
Cl – H2
Cuando las moléculas de HCl se disuelven en agua, se rompe el enlace, pero se forman los iones que existián en la molécula gaseosa.
La polaridad del enlace es un índice del grado de carácter iónico de un enlace covalente. Existe toda una graduación en el enlace químico entre el iónico puro y el covalente hompola. En la figura de la dercha se presentan los modelos estructurales correspondientes a este gráfico.
En el agua H2O el hidrógeno tiene un electón de valencia y el oxígeno, seis electrones. Al unirse para adquirir una estructura estable, cada hidrógeno comparte un electrón con el oxígeno, y así adquieren una estructura estable con dos electrones.
El oxígeno adquiere una estructura estable de ocho electrones, con los dos electrones que comparte con los hidrógenos. Los electrones compartidos son atraídos con más fuerza por el óxigeno que por el hidrógeno, por ser el óxigeno más electronegativo y, como consecuencia, los electrones se concentran en torno al óxigeno.
La molécula de agua es un dipolo con el polo negativo del lado del oxigeno y el polo positivo en la zona donde estan los hidrógenos. También en la molécula del agua se produce un desplazamiento de los núcleos de los átomos respecto a las capas electrónicas a este fenómeno se le conoce con el nombre de deformación atómica.
La causa de que el agua sea el mejor disolvente de las sustancias iónicas es la polaridad de sus moléculas. Así cuando una sustancia ónica se pone rn contacto con los dipolos que forman las moléculas del agua, estos se orientan en sentido opuesto a la polaridad de ion y provocan una disminución de la fuerza de atracción electrostática entre los iones del cristal hasta lograr su desintegración.
Cuando los iones que forman en cristal se separan, estos quedan rodeados por dipolos del agua, es decir por el disolvente, lo que impide reagruparse de nuevo. Este fenómeno se denomina solvatación, y a los iones rodeados por los dipolos se llaman iones solvatados
Enlace covalente coordinado o dativo
Este enlace tiene lugar entre átomos distintos Enlace covalente coordinado o dativo entre dos átomos es el enlace en el que cada par de elecrones compartidos por dos átomos es aportado, por uno de los átomos. El átomo que aporta el par de electrones se denomina dador y el que recibe es receptor.
El enlace coordinado se representa por medio de una flecha (-->) que parte del átomo que aporta los dos electrones y se dirige hacia el que no aporta ninguno. Un ejemplo de enlace coordinado lo tenemos cuando se forma el catión amonio NH4+, a partir del amoníaco NH3 y el ion de hidrógeno H+
En la reacción anterior, el amoníaco se une con un protón H+ para formar el ion amonio MH3. El amoníaco aporta un par de electrones que son compartidos por el ion H+ , el cual adquiere de esta forma la configuración estable del gas noble He.
Propiedades de las sustancias covalentes
Las sustencias covalentes en general se caracterizan porque:
- Tienen bajos puntos de fusión y de ebullición.
- Cuando se trata de cuerpos sólidos son relativamente blandos y malos conductores del calor y de la electricidad
- Son bastante estables y de escasa reactividad ya que el enlace es fuerte.
Por lo tanto, en las sustancias covalentes podemos distinguir:
- Gases como O2, H2, N2, CO2, los átomos en cada molécula están unidos por enlaces covalentes, pero entre ellas las fuerzas de unión son muy débiles, las moléculas están dispersas y, por tanto, forman sustancias gaseosas.
- Líquidos como el H20, las fuerzas de unión, entre las moléculas de agua son más intensas. Las moléculas permanecen en contacto, aunque con libertad para deslizarse una sobre otras.
- Sólidos como el yodo, el diamante o el cuarzo. Estos dos últimos son muy duros, mucho más que los sólidos iónicos, y con altos puntos de fusión y ebullición. En el diamante, cada atómo de carbono se une con otros cuatro formando una red cristalina covalente.
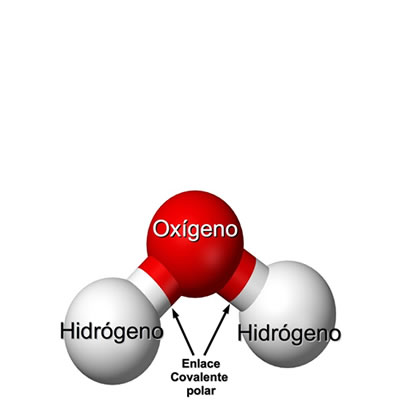 Enlaces covalentes polares
Enlaces covalentes polaresLa molécula de agua presenta dos enlaces covalentes polares entre el oxígeno y los hidrógenos. En la molécula de agua H₂O los electrones de los hidrógenos permanecen más cerca y por mayor tiempo alrededor del oxígeno, que es más electronegativo.
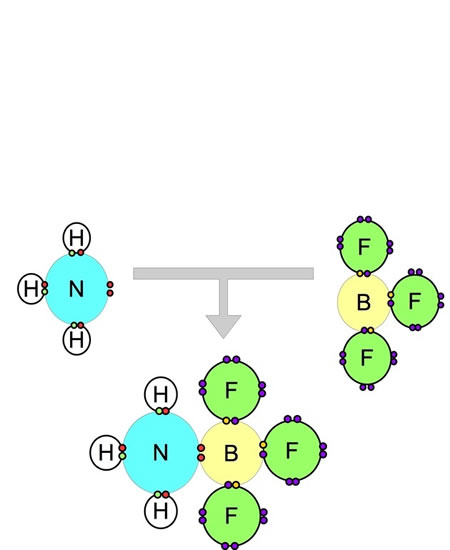 Enlace covalente coordinado o dativo
El nitrógeno en el amoníaco aporta dos electrones al boro en el aducto amoníaco-trifluoruro de boro.
Este tipo de enlace se presenta cuando uno de los átomos en la unión es el que aporta los electrones a compartir. Esto lo conseguimos en la reacción entre el amoníaco NH3y el trifluoruro de boro BF3. El nitrógeno tiene dos electrones libres y el boro está deficiente de electrones. Al unirse tanto el nitrógeno como el boro completan su última capa con ocho electrones.
Enlace covalente coordinado o dativo
El nitrógeno en el amoníaco aporta dos electrones al boro en el aducto amoníaco-trifluoruro de boro.
Este tipo de enlace se presenta cuando uno de los átomos en la unión es el que aporta los electrones a compartir. Esto lo conseguimos en la reacción entre el amoníaco NH3y el trifluoruro de boro BF3. El nitrógeno tiene dos electrones libres y el boro está deficiente de electrones. Al unirse tanto el nitrógeno como el boro completan su última capa con ocho electrones.