Cálculos estequimétricos en las reacciones químicas
Cuando leemos una ecuación química podemos obtener información sobre el tipo y número de especies químicas(átomos,moléculas, etc) que intervienen y también sobre el número de moles que reaccionan y se forman
Una reacción química ajustada nos indica la proporción de moléculas reaccionan de cada reactivo y la proporción de moléculas se forman de cada producto. Los cálculos estequiométricos se basan en las relaciones fijas de combinación que hay entre las sustancias en las reacciones químicas balanceadas. Estas relaciones están indicadas por los subíndices numéricos que aparecen en las fórmulas y por los coeficientes. Este tipo de cálculos es muy importante y se utilizan de manera rutinaria en el análisis químico y durante la producción de las sustancias químicas en la industria.
Pasos a seguir
Los cálculos que vamos a abordar este curso son aquellos en los que reaccionan totalmente los reactivos, ni sobra ni falta ninguno de ellos.
Los pasos que debes seguir son los siguientes:
- Escribir la ecuación química del proceso o transformación química, expresando las fórmulas de reactivos y productosy luego ajustar la ecuación correspondiente.
- Establecer las relaciones, derivadas de los coeficientes estequimétricos, del ajuste de la reacción, entre moles de los reactivos y los productos.
- A partir de las masas molecualres de las sustancias que intervienen, establecer las relaciones entre las masas o volumenes si se trata de gases de las sustencias correspondientes.
- Partiendo de los datos conocidosy aplicando la relación matemática de proporcionalidad directa para conocerlas cantidades desconocidas.
Cálculo de masas
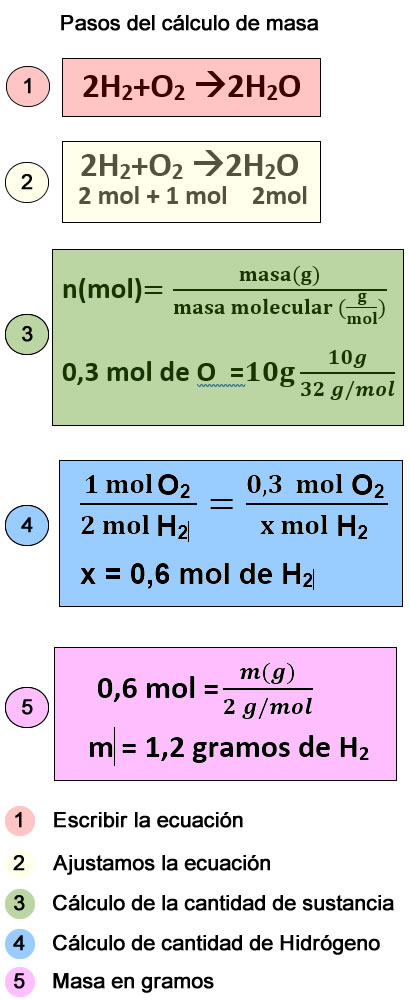
Para aprender a hacer cálculos en las reacciones químicas, lo mejor es
comenzar con un ejemplo. Leemos el siguiente enunciado:
En la reacción entre el oxígeno y el hidrógeno para
dar agua ,calcular la masa de hidrógeno que reacciona con 10 gramos de oxígeno
El primer paso es escribir y ajustar la reacción;
2H2+O2 à2H2O
Se indica debajo de cada sustancia que interviene en la reacción la
cantidad de sustancia en un mol. Los moles coinciden con el coeficiente
estequiométrico (número que aparece delante de cada componente) y si no tiene coeficiente
es que no tiene y vale 1 mol.
2H2+O2 à 2H2O
2 mol + 1 mol
2mol
El segundo paso es calcular la cantidad de sustancia de la que tengamos datos (en este caso 10g de O). A partír de aquí podremos calcular cualquier dato quye nos pidan como veremos 10 gramos de O2 son
El tercer paso es calcular la cantidad de H2, para ello plateamos la
proporción entre la cantidad de H2 y O2 que reacciona.
Según los coeficientes de la reacción ajustada.
1 mol de O2 reacciona con 2 mol de H
2
El último paso es calcular la masa en gramos de H2, sabiendo que son 0,6 mol
Cálculo de volúmenes
En las reacciones químicas tanto los reactivos como los productos pueden
estar en cualquier estado de agregación.
Cuando en la reacción intervienen gases, es importante saber realizar
cálculos con volúmenes, ya sabemos que un mol de cualquier gas en condiciones
normales 0C y 1 atmósfera ocupa un volumen de 22,4 litros.
Con esta equivalente es muy facil calcular volúmenes en reacciones en
las que intervienen gases, ya que las proporciones que existen entre los moles
en las reacciones químicas son las mismas que hay entre los volúmenes de
sustancias gaseosas.
La afirmación que acabamos de hacer se puede comprobar
experimentalmente. Cuando realizamos la electrólisis del agua se obtiene un
volumen de hidrógeno del doble que el del oxígeno si contratamos este hecho con
la descomposición tenemos
2H2Oà 2H2 +O (g)
2 mol 2 mol
1 mol
Observa que, además de obtener el doble de volumen, también obtenemos el
doble de cantidad de sustancia. Esta realción entre volúmenes y cantidad de
sustancias en los gases es muy util para simplificar cálculos en problemas.