Enlace metálico
Un pedazo de cualquier metal esta formado por miles de millones de átomos de dicho elemento unidos mediante enlace metálico. Algunos metales como el sodio y el magnesio pueden extraerse de los océanos en donde se encuentran disueltos. Los demas metales se suelen obtener a partir de depósitos minerales en la corteza terrestre.
Formación de cristales metálicos
Los átomos del metal se distribuyen en el espacio de forma muy ordenada, determinando estructuras cristalinas, llamadas cristales metٞálicos geometricamente regulares como cubos, prismas, etc
Podemos imaginar la formación de uno de estos cristales así:
- Todos los átomos se desprenden de los pocos electrones que les sobran para alcanzar los mismos que el gas noble más cercano, que suele el del período anterior. El conjunto de electrones forma la «nube electrónica» o «gas electrónico».
- Los iones positivos o cationes resultantes se empaquetan conformando un cuerpo geómetrico regular. Como son cargas eléctricas del mismo signo, tienden a repelerse entre sí, pero el gas electrónico se mueve entre los huecos dándole consistencia y estabilidad.
En las sustancias metálicas, como en las iónicas, no hay moléculas, sino redes infinitas de cationes, formando una red cristalina metálica. La fórmula de un metal se representa simplemente con el símbolo del elemento, por ejemplo, Fe, Mg, etc.
Los metales forman aleaciones, es decir mezclas homogeneas entre metales como el bronce (cobrey estaño), o el latón (cobre y cinc), también hay mezclas con los no metales como por ejemplo el acero (hierro y carbono).
Los cinco magnificos
Entre las muchas clases de sustancia puras que nos regala la naturaleza están los metales que han tenido una importancia decisiva en la historia de la humanidad, como la edad de los metales o la búsqueda de oro como en el desarrollo industrial o el uso del cobre en los tendidos eléctricos. Los metales han sido y continuan con la permanente investigación de nuevas aleaciones para necesidades específicas. Los metales han sido y son fuente de preocupación científica y factores de progreso en todos los ámbitos de actividad humana.
Metales hay muchos y muy variados, vamos a fijarnos ahora en cinco de ellos porque ser representativos de casi todos los demás, son nuestros «cinco magnificos», el sodio el magnesio, el hierro, el cobre y la plata. Todos ellos presentan brillo metálico, conducen bien el calor y la electricidad, se pueden extender en láminas (maleables) y estirar en hilos (dúctiles).
Propiedades de los metales
- Casi todos los metales son sólidos a temperatura ambiente (el mercurio, el galio y el cesio constituyen las únicas excepciones son líquidos)
- Son conductores de calor
- Se pueden deformar facilmente, son maleables (pueden extenderse en planchas o láminas) y dúctiles pueden formar alamabres o hilos.
- Conducen la corriente eléctrica, si conectamos el metal a los electrodos de una pila, la nube electrónica se puede poner facilmente en movimiento y circularm creándose una corriente eléctrica, el electrodo negativo repele a los electrones y el positivo los atrae.
- Poseen brillo metálico y de densidad elevada (excepto el litio , el sodio y el potasio, todos son más densos que el agua). El oro, por ejemplo, tiene una densidad de 19,3 g/cm3.
- Tienen elevados puntos de fusión y ebullición (salvo aquellos son líquidosa temperatura ambiente) . En el oro el punto de fusión es 1063ºC y el de ebullición 2970 ºC.
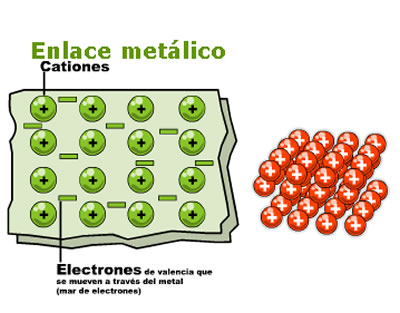 Enlace metálico
Los átomos de los metales en estado sólido están unidos por medio del enlace metálico. Todos y cada uno de los átomos del metal comparten, con todos los demás los electrones de la capa de valencia, formando así una red tridimensional y compacta de cationes ordenados cristal metálico inmersa en una nube de electrones compartidos.Esta estructura tiene gran estabilidad.
Enlace metálico
Los átomos de los metales en estado sólido están unidos por medio del enlace metálico. Todos y cada uno de los átomos del metal comparten, con todos los demás los electrones de la capa de valencia, formando así una red tridimensional y compacta de cationes ordenados cristal metálico inmersa en una nube de electrones compartidos.Esta estructura tiene gran estabilidad. El enlace metálico es un vínculo atómico muy fuerte y primario y gracias a este tipo de enlace los metales logran estructuras moleculares sumamente compactas, sólidas y resistentes, dado que los núcleos de sus átomos se juntan a tal extremo, que comparten sus electrones de valencia.
El enlace metálico es un vínculo atómico muy fuerte y primario y gracias a este tipo de enlace los metales logran estructuras moleculares sumamente compactas, sólidas y resistentes, dado que los núcleos de sus átomos se juntan a tal extremo, que comparten sus electrones de valencia.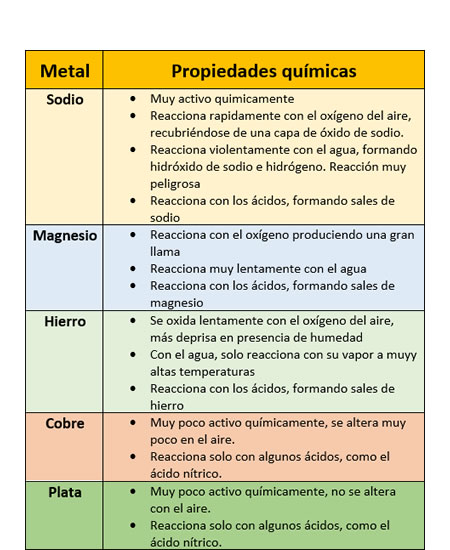 Propiedades de algunos metales
Propiedades de algunos metales