Leyes de las reacciones químicas
En una reacción química se produce una transformación de la materia con sus propiedades características como densidad, color, punto de fusión, etc. de los productos de la reacción no son las mismas que las de los reactivos.
Las ecuaciones químicas
En una ecuación química hay dos términos, en el primero, el de izquierda, se escriben los reactivos expresados mediante sus fórmulas químicas correspondientes y separadas por un signo más. A la derecha se escribe el segundo término, en el que aparecen los productos, también representados por sus fórmulas químicas y con signos más entre ellos. Entre ambos términos suele ponerse una flecha que indica que se ha producido la reacción química correspondiente.
Reactivos ⇒ Productos
Toda ecuación química debe estar ajustada, debido a que los átomos en una reacción química no varían, por tanto, el número de átomos en los reactivos es el mismo que en los productos, lo que sucede es que los átomos se ordenan de diferente forma. Pero hay que tener en cuenta que no siempre hay dos sustancias reaccionantes, ni aparece un producto de reacción, sino que existen diversas posibilidades.
Vamos a enunciar algunas leyes fundamentales de las reacciones químicas que tienen que ver con las masas de los reactivos y de los productos.
Ley de Lavosier o de conservación de la masa
Ley de Proust o de las proporciones definidas
Ley de Daltón o de las proporciones múltiples
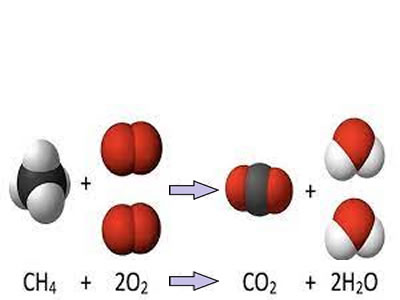 Balance de ecuaciones químicas
Balance de ecuaciones químicasEl balance de ecuaciones químicas es un procedimiento mediante el cual se hace cumplir la Ley de Lavoisier dentro de una reacción química. Para ello, la cantidad de átomos en reactantes tiene que ser igual a la cantidad de átomos en productos, ya que no existe formación ni pérdida de éstos, sino que simplemente una recombinación, es decir, los átomos se ordenan de una manera distinta cuando se someten a una reacción química.
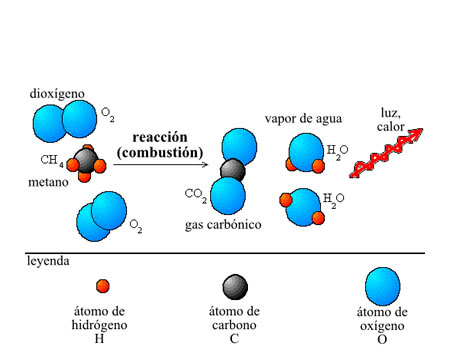 Ley de conservación de la materia o Ley Lavoisier
Ley de conservación de la materia o Ley LavoisierLa ley de conservación de la materia o Ley Lavoisier es un principio de la química que plantea que la materia no se crea ni se destruye durante una reacción química, solo se transforma. Esto significa que las cantidades de las masas involucradas en una reacción determinada deberán ser constantes, es decir, la cantidad de reactivos consumidos es igual a la cantidad de productos formados, aunque se hayan transformado los unos en los otros.
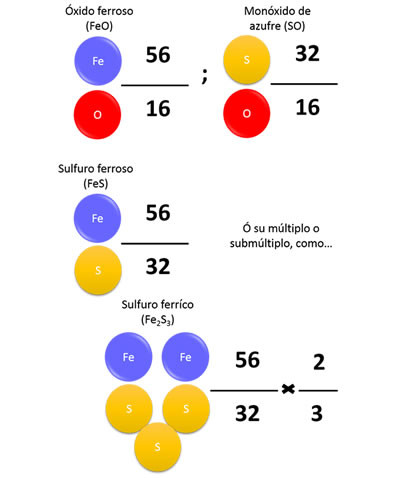 Ley de las proporciones múltiples o de Dalton
Ley de las proporciones múltiples o de DaltonEste proceso ocurre cuando se mezclan dos elementos para formar más de un compuesto,uno de ellos mantiene siempre su misma masa mientras el otro se mezcla con masas variables del otro.Ambos guardan una relación simple de números enteros.
