Enlace iónico
El enlace iónico consiste en la union de ionescon cargas de signo contrario, mediane fuerzas de tipo electrostático, formando grandes cristales de iones positivos y negativos llamados cristales iónicos
Un enlace iónico es el resultado de la presencia de atracción electrostática entre los iones de distinto signo respecto a las valencias de los elementos y el número de electrones que deben perder o ganar para completar las capas, es decir, uno fuertemente electropositivo y otro fuertemente electronegativo. Eso se da cuando en el enlace, uno de los átomos capta electrones del otro. La atracción electrostática entre los iones de carga opuesta causa que se unan y formen un compuesto químico simple, aquí no se fusionan; sino que uno da y otro recibe.
El enlace iónico se produce normalmente cuando se unen metales con no metales
- Los metales forman iones positivos.
- Los no metales forman iones negativos
Algunas características de este tipo de enlace son:
- Los enlaces son muy fuertes (depende fuertemente de la naturaleza de los iones).
- Sólidos a temperatura ambiente y poseen una estructura cristalina o transparente en el sistema cúbico. (Hay compuestos iónicos que son líquidos a temperatura ambiente denominados "líquidos iónicos" o "Sales Derretidas", con un campo de aplicación gigantesco.)
- Altos punto de fusión (entre 300 °C y 1000 °C) y ebullición (Si el enlace tiene un carácter covalente alto, puede ser que estos valores disminuyan abruptamente)
- Son enlaces resultantes de la interacción entre los metales de los grupos I y II y los no metales de los grupos VI y VII.
- Son solubles en agua y otras disoluciones acuosas debido al dipolo eléctrico que presentan las moléculas de agua; capaces de solvatar a los iones, compensando así la energía de red cristalina. (No todos los compuestos iónicos se pueden disolver fácilmente con agua, ya sea por la poca energía de solvatación de los iones o por el carácter covalente del compuesto iónico).
- Una vez en disolución acuosa son excelentes conductores de electricidad, ya que entonces los iones quedan libres. (Hay una gran variedad de compuestos iónicos que son poco o muy poco solubles en disolución acuosa, también debido al carácter covalente del compuesto y que no permite que el agua separe fácilmente la red cristalina, resultando así en una muy pobre conductividad en disolución)
- Posee únicamente enlaces simples.
- En estado sólido no conducen la electricidad, ya que los iones ocupan posiciones muy fijas en la red. Si utilizamos un bloque de sal como parte de un circuito en lugar del cable, el circuito no funcionará. Así tampoco funcionará una bombilla si utilizamos como parte de un circuito un cubo de agua, pero si disolvemos sal en abundancia en dicho cubo, la bombilla del circuito se encenderá. Esto se debe a que los iones disueltos de la sal son capaces de acudir al polo opuesto (a su signo) de la pila del circuito y, por ello, este funciona.
El mejor ejemplo “la sal de mesa”
Para explicar la formación de un compuesto iónico, nos fijamos en el proceso de formación del cloruro de sodio, NaCl mas conocido como la sal común.
Podemos distinguir las siguientes etapas:
- Cada átomo de sodio cede un electrón un átomo de cloro y se convierten el átomo de sodio en ion positivo y cloro en ion negativo. Observe lo siguiente:
Na -> Na++1e-
Cl+1e- ->Cl-
- El proceso de cesión de un electrón del átomo de sodio al del cloro se repite con muchos pares de átomos de sodio y cloro, porque en una reacciónreal intervienen incontables pares.
- Una vez formados los iones para aumentar las atracciones entre iones de distinto signo y reducir al mínimo las repulsiones entre iones de igual signo, los iones Na+ y Cl- se colocan en forma ordenada en una red cristalina.
- Los iones situados en la red cristalina están unidos por fuerzas de tipo electrostático (fuerzas de Coulomb) que mantienen la estabilidad del compuesto.
Como hemos visto, la formación del cristal iónico se produce tras una serie de etapas conocidas técnicamente como ciclo de Born-Haber, que pueden resumirse en dos :
- Formación de los iones
- Construcción del cristal iónico
En los compuestos iónicos no existen moléculas propiamente dichas, sino agregados de iones en la proporción indicada por su fórmula, los cuales constituyen la red cristalina. La ruptura de esta red puede ser por fusión, dilución y requieren el aporte de energía.
Propiedades de un enlace iónico
Los compuestos formados por enlaces iónicos presentan una serie de propiedades como resultado de la fuerte atracción entre cargas que se produce en dichos enlaces, determinando su comportamiento químico. A saber.
- Son neutros en estado sólido: cuando están en estado sólido, la carga eléctrica de los enlaces iónicos es neutra.
- Suelen cristalizarse: debido a la estructura tridimensional de un enlace iónico, estos favorecen redes cristalizadas frágiles.
- Altos puntos de ebullición y fusión (300º C a 1000º C): ya que existe una fuerza de atracción muy potente entre los iones, estos deben someterse a altos puntos de fusión o ebullición para modificar su estado.
- Sólidos en temperaturas entre 20º C y 30º C: en consecuencia de lo anterior, los enlaces iónicos suelen ser sólidos a temperatura ambiente.
- Buenos conductores de electricidad: los enlaces iónicos son buenos conductores de electricidad siempre que estén disueltos en agua.
Estructura de los cristales iónicos
Las sustancias iónicas presentan unas estructuras muy ordenadas, muy cristalinas ya que los iones que las conforman suelen ocupar unas posiciones en el espacio tales que determinan figuras geométricas regulares, como cubos, tetraedros u octaedros. Por esta razon, a la estructura formada la llamaremos cristal iónico.
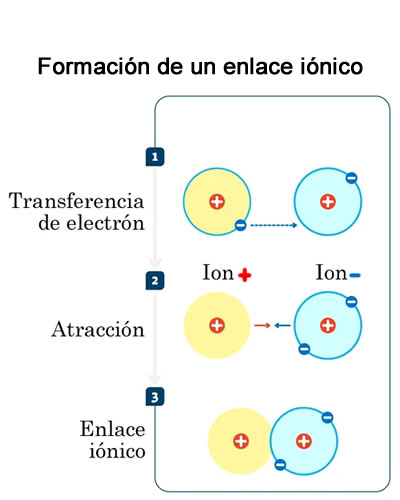 Enlace iónico
Enlace iónicoUn enlace iónico es un tipo de enlace químico que ocurre cuando un átomo cede un electrón al otro, a fin de que ambos alcancen estabilidad electrónica. Esta unión normalmente se produce entre elementos metales y no metales con diferente electronegatividad, lo que significa que los elementos tienen diferente capacidad para atraer electrones.
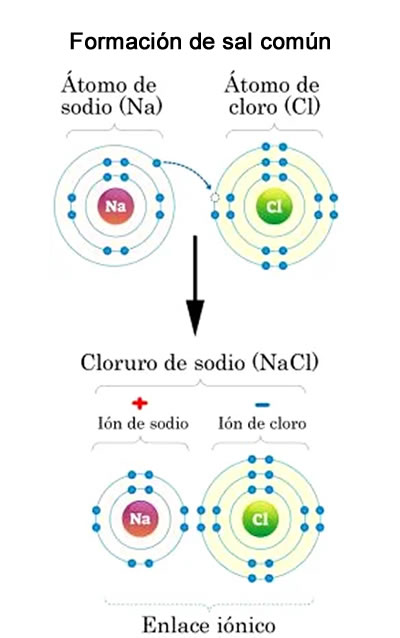 Ejemplo de enlace iónico en la sal común
Ejemplo de enlace iónico en la sal comúnEl sodio (Na) tiene un electrón de valencia en la última capa electrónica, mientras que el cloro (Cl) tiene siete. Cuando el sodio y el cloro se aproximan, el sodio cede su electrón al cloro. Este, suma entonces 8 electrones de valencia. Cuando el sodio pierde su electrón, gana una carga positiva y se convierte en un catión. Cuando el cloro gana un electrón, se hace negativo y se convierte en un anión. Dado que las cargas positivas y negativas se atraen, ambos iones se unen formando un enlace iónico. Este compuesto en particular, formado a partir de enlaces iónicos, es cloruro de sodio (NaCl), nombre químico de la sal de mesa.
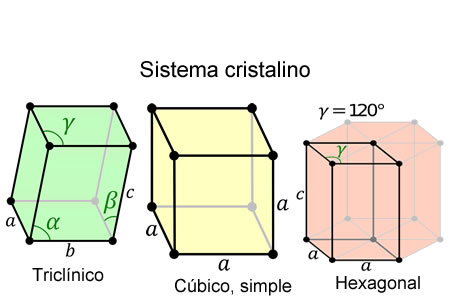 Estructuras de los cristales iónicos sencillos
Estructuras de los cristales iónicos sencillosLos cristales están formados por átomos, iones y/o moléculas que se empaquetan conjuntamente de un modo ordenado y periódico. Este hecho es la evidencia de la presencia de determinadas fuerzas que mantienen los átomos unidos .
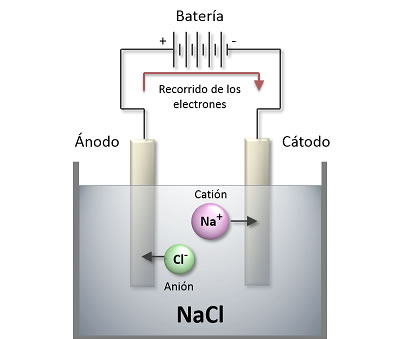 Electrólisis
Electrólisis La electrólisis es un proceso donde la energía eléctrica cambiará a energía química, el proceso sucede en un electrólito, una solución acuosa o sales disueltas que den la posibilidad a los iones de ser transferidos entre dos electrodos que están conectados con una corriente directa.
