Producción de reacciónes químicas
Para explicar cómo ocurre una reacción química nos ayudamos con la teoría de las colisiones. Esta teoría considera a las moléculas como partículasque chocan continuamente unas con otras.
Teoría de colisiones
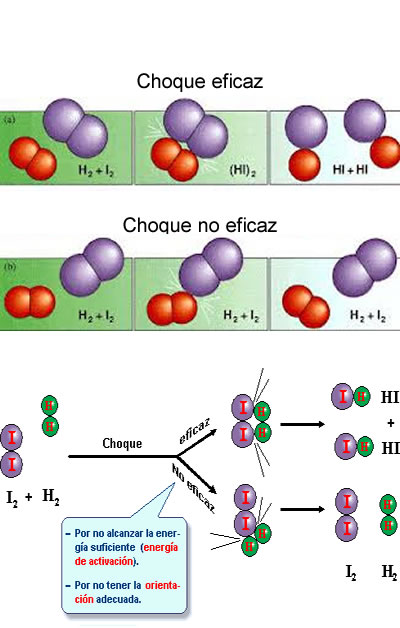
La teoría de las colisiones es una teoría propuesta por Max Trautz1 en 1916 y por William Lewis en 1918, que explica cómo ocurren las reacciones químicas y por qué las velocidades de reacción difieren para diversas reacciones. Para que una reacción ocurra, las partículas reaccionantes deben colisionar. Solo una cierta fracción de las colisiones totales causan un cambio químico; estas son llamadas colisiones exitosas o completadas.
Las colisiones exitosas tienen energía suficiente (energía de activación), al momento del impacto, para romper los enlaces existentes y formar nuevos enlaces, resultando en los productos de la reacción. El incrementar la concentración de los reactivos y aumentar la temperatura lleva a más colisiones y por tanto a más colisiones exitosas, incrementando la velocidad de la reacción.
Cuando un catalizador está involucrado en la colisión entre las moléculas reaccionantes, se requiere una menor energía para que tome lugar el cambio químico, y por lo tanto más colisiones tienen la energía suficiente para que ocurra la reacción. La velocidad de reacción por lo tanto también se incrementa.
Se basa en la teoría cinético-molecular de los gases, puesto que en una reacción química tiene lugar la ruptura de enlaces entre los átomos de las moléculas de los reactivos y la formación de nuevos enlaces para originar las moléculas de los productos, es necesario que las moléculas reaccionantes entren en contacto, “choquen”, por lo que a mayor número de choques, mayor velocidad de reacción. Ahora bien, no todos los choques son eficaces (se rompen los enlaces), para esto se requiere:
- Las moléculas han de tener suficiente energía cinética para que al chocar, los enlaces se rompan o se debiliten. Esta mínima Ec se llama Energía de activación, y las moléculas que la poseen se llaman moléculas activadas.
- El choque tiene que producirse en la dirección adecuada.
Velocidad de reacción
La velocidad de reacción es la cantidad de sustancia transformada por unidad de tiempo, esto nos indica la rapidez con la que los reactivos se convierten en productos.
La unidad de velocidad de reacción es mol (Lxs)
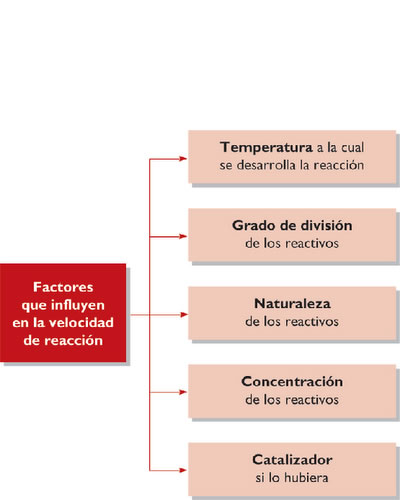
Factores que afectan a la velocidad de una reacción química
Temperatura
Al aumentar la temperatura, también lo hace la velocidad a la que se mueven las partículas y, por tanto, aumentará el número de colisiones y la violencia de estas. El resultado es una mayor velocidad en la reacción. Se dice, de manera aproximada, que por cada 10 °C de aumento en la temperatura, la velocidad se duplica. Esto explica por qué para evitar la putrefacción de los alimentos los metemos en la nevera o en el congelador. Por el contrario, si queremos cocinarlos, los introducimos en el horno o en una cazuela puesta al fuego.
Para una reacción:
aA + bB ⇒ cC + dD
v = k [A]α [B]β
α : orden o grado de la reacción respecto de A
β : orden o grado de la reacción respecto de B
α+β : orden o grado total de la reacción
Catalizadores y sus funciones
- Catalizadores positivos o promotores. Son los que aceleran el proceso de la reacción química.
- Catalizadores negativos o inhibidores. Reducen la velocidad de la reacción química.
- Venenos catalíticos. Se encargan de desactivar el proceso de catálisis.
- Homogéneos: cuando los catalizadores están en la misma fase que los reactivos. Actúan cambiando el mecanismo de reacción, es decir, se combinan con alguno de los reactivos para formar un intermedio inestable que se combina con más reactivo dando lugar a la formación de los productos, al mismo tiempo que se regenera el catalizador.
- Heterogéneos o de contacto: cuando los catalizadores están en distinta fase que los reactivos. Son materiales capaces de absorber moléculas de reactivo en sus superficies, consiguiendo mayor concentración y superficie de contacto entre reactivos, o debilitando sus enlaces disminuyendo la energía de activación. Los productos abandonan el catalizador cuando se forman, y este queda libre para seguir actuando. Los catalizadores heterogéneos más usados son metales u óxidos de metales finamente divididos, como por ejemplo el hierro, el platino, el níquel, el trióxido de aluminio o el pentaóxido de vanadio.
 Teoría de colisiones
Teoría de colisionesLa teoría de colisiones es un modelo para explicar los mecanismos de las reacciones químicas, según esta teoría para que se produzca una reacción deben cumplirse tres condiciones, en la primera de ellas las moléculas de los reactivos tienen que chocar entre sí, la segunda condición dice que estos choques deben de producirse con energía suficiente de forma que se puedan romper y formar enlaces químicos y la tercer condición en el choque debe haber una orientación adecuada para que los enlaces que se tienen que romper y formar estén a una distancia y posición viable.

 Velocidad de reacción
Velocidad de reacciónLa velocidad de reacción se define como la cantidad de sustancia que se transforma en una determinada reacción por unidad de tiempo. Por ejemplo, la oxidación del hierro bajo condiciones atmosféricas es una reacción lenta que puede tardar muchos años pero la combustión del butano en un fuego es una reacción que sucede en fracciones de segundos
 Ejemplos de tipos de velocidad de reacción
Ejemplos de tipos de velocidad de reacciónDos tipos de diferentes tipos de recciones quimicas en el caso de la corrosión del hierro es una reacción con una velocidad de reacción lenta, mientras que en el caso de la madera ardiendo es una reacción con una velocidad de reacción rápida.
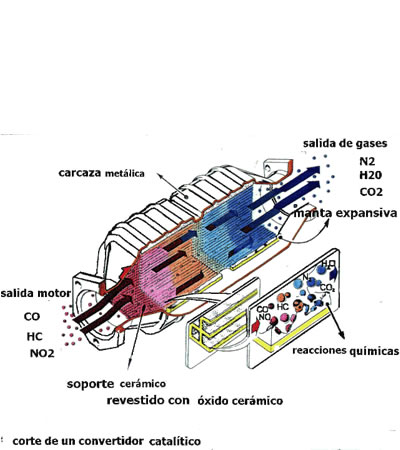 Catalizador de coche
Catalizador de cocheEl Catalizador es un elemento depurador de los gases de escape y su funcionamiento se basa en que contiene metales (sobre todo platino y rodio en proporciones muy pequeñas) que facilitan la reacción entre los gases de escape y el oxígeno del aire, para convertirlos en sustancias menos perjudiciales. Los catalizadores llamados de oxidación consiguen que el monóxido de carbono CO que se genera durante la combustión se convierta en dióxido de carbono CO2 al tomar oxígeno (el primero es un gas tóxico y el segundo no), y también quema los hidrocarburos (aunque parezca increíble, parte del combustible que entra en los cilindros sale intacto) provocando una reacción de combustión en la que se desprende CO2 y vapor de agua. También hay catalizadores de tres vías, que además de oxidar (añadir oxígeno) pueden reducir (quitar oxígeno) ciertos gases de escape. Así, el monóxido NO y dióxido de nitrógeno NO2 se convierten en nitrógeno N2 y oxígeno O2. La temperatura normal de funcionamiento de un catalizador es de unos 800°C, y no pueden funcionar con gasolina con plomo, pues este metal se deposita sobre los componentes del catalizador, anulando su rendimiento.
