Enlace químico y estabilidad
Los átomos no suelen permanecer aislados, si no que tienden a agregarse entre si formando unas estructuras más complejas se unen porque ello les permite a una situación de menor energía, lo que supone también mayor estabilidad.
Uniones entre átomos
Una de los problemas más importantes de la química del siglo XIX fue la justificacion de las uniones entre átomos. La teoría del enlace químico comenzó con el trabajodel químico aleman Richard Abegg, al explicar las uniones entre los átomos en términos de electrones, esta teoría da respuesta a preguntas como:
- ¿Por que el óxigeno que respiramos, sustancia formada por moléculas constituidos por dos átomos de ٗóxigeno, responde a O2 y no O?
- ¿Cómo se explica que el hidrógeno se una al óxigeno para formar moléculas de agua(H2O)?
- Si solo se dispone de un número reducido de elementos químicos ¿ por qué existen la cantidad de sustancias diferentes?
En el átomo, los electrones más estables son los situados en los niveles energéticos más profundos de la corteza terrestre atómica. Se puede considerar, desde el punto químico, que los átomos están formados por dos partes, una de ellas formada por el nucleo y los electrones profundos y otra formada por los electrones de la capa electrónica más externa responsable del comportamiento químico. A los electrones de esta capa se las llama electrones de valencia y a dicha capa, capa de valencia
Estabilidad
¿Por qué se unen los átomos?
Los cuerpos ordinarios en la naturaleza tienden espontaneamente a alcanzar
situaciones de mínima energía porque esto implica una mayor estabilidad.
Admitiendo el mismo comportmiento para el mundo de los átomos se podría afirmar
que:
Los átomos se unen porque ello le permite pasar a una situación de menor
energia, lo cual supone también mayor estabilidad.
Cuando dos átomos se unen formando un enlace químico, desprenden una energia
llamada energia de enlace. Esto es de gran importancia en nuestro mundo,
ya que la liberación de esa energía de enlace es la fuente de energía más
utilizada en el planeta tierra.
Un enlace químico se produce como resultado de la interacción
electrostática entre los nucleos y los electrones de los átomos que se unen.
Solo intervienen los electrones de los átomos que se unen. Solo intervienen los
electrones de la capa de valencia, quedando inalterados el núcleo y los electrones
más próximos al mimso.
Dos átomos, cuando se encuentran distantes no interaccionan entre si, pero conforme se van acercando aparece una atracción entre el núcleo de un átomo y los electrones del otro. Simultáneamente surge una repulsiٔón entre los dos núcleos cargados positivamente y lo mismo ocurre entre los electrones de los dos átomos cargados negativamente.Longitud y energía de enlace
Cuando se forma un enlace químico se desprende energía. Por el
contrario, si deseamos romper el enlace formado, debemos aportar externamente
esa misma cantidad de energía. Así, se define la energía de enlace como
la energía liberada cuando se forma un mol de enlaces a partir de los átomos
en estado gaseoso y fundamental. A estas energías de enlace se las llama
también entalpías de enlace, como veremos en el tema de termoquímica.
Cabe destacar que cuanto mayor es la energía desprendida en la formación
de un enlace más energía se requiere para romperlo y, por tanto, más estable
es.
Longitud de enlace o distancia internuclear
La longitud de enlace es la distancia de equilibrio entre los
núcleos atómicos, el valor del valle en la curva de estabilidad energética.
Esta distancia internuclear es medible experimentalmente por técnicas
espectroscópicas o de difracción.
Es preciso indicar, no obstante, que los valores de las tablas solo son
promedios, ya que los átomos no permanecen fijos en el espacio, sino que se
hallan vibrando en torno a una posición de equilibrio. Cabe añadir, además, que
si tenemos enlaces múltiples, aumenta la energía de enlace y disminuye
la distancia de enlace.
Ángulo de enlace
El ángulo de enlace sólo tiene sentido cuando consideramos 3
átomos, y es el ángulo formado por los ejes imaginarios que unen el núcleo del átomo
central con los núcleos de los átomos unidos a él.
En cuanto a la polaridad del enlace, dada su importancia, lo
trataremos con profundidad en el apartado «Polaridad del enlace y polaridad
molecular». La energía de la molécula de
hidrógeno es menor que la suma de las energias de los dos átomos que la forman.
Esta diferencia de energías se conoce como energía de enlace (Ee) y
se define como la energía necesaria para romper el enlace entre dos átomos
separándoles a una distencia infinita. Las energías de enlace se dan en kilocalorias
por mol de moléculas formadas o separadas. La longitud del enlace se mide en
anstrom (Å) 1 Å = 10-10 m
Regla del octeto
Los gases nobles (He,Ne,Ar, Kr, Xe,Rn) se encuentran en la naturaleza en
forma atómica y no tienden a formar compuestos. Los gases nobles se
caracterizan por tener todos sus niveles y subniveles energéticos completamente
llenos. La estabilidad de los gases nobles se asocia con la estructura
electrónica de su última capa con ocho electrones.
Los gases nobles, debido a sus escada reactividad química se empelan en
entornos en los que interesa que no se produzcan cambios químicos. Por ejemplo
en el interior de las lámparas se usa un gas inerte el argón, si hubiese aire
el filamento metálico reaccionaría rapidamente con el oxígeno inutilizando la
lámpara.
La teoría del octeto, fue enunciada en 19161 por el fisicoquímico
Gilbert Newton Lewis,y dice que los iones de los elementos del sistema
periódico tienen la tendencia a completar sus últimos niveles de energía con
una cantidad de 8 electrones, de tal forma que adquieren una configuración muy
estable. Esta configuración es semejante a la de un gas noble. Los gases nobles
son elementos electroquímicamente estables, ya que cumplen con la estructura de
Lewis, son inertes, es decir que es muy difícil que reaccionen con algún otro
elemento. Esta conclusión es conocida como la regla del octeto.
Esta regla es aplicable para la creación de enlaces entre los átomos, la
naturaleza de estos enlaces determinará el comportamiento y las propiedades de
las moléculas. Estas propiedades dependerán por tanto del tipo de enlace, del
número de enlaces por átomo, y de las fuerzas intermoleculares.
Una manera de obtener el octeto es perdiendo o ganandeo electrones
·
El cloro Cl con 7 electrones externos tiende a captar
uno más y se convierte en Cl-
·
Al Sodio Na le resulta más facil perder un electróny
no captar siete queda convertido en Na+
Formación de iones
Los átomos son neutros si tienen el mismo número de protones y electrónes,
pero tambien pueden ganar o perder electrones y convertirse en iones que pueden
ser positivos o negativos. En este caso, el número de protones y el número de
electrones ya no es el mismo, por lo tanto, el átomo ya no es neutro.
Si un átomo gana electrones, quedará con exceso de carga negativa,
transformándose en un ion negativo o anión
Si el azufre 16S que tiene 16 protones y 16 electrones, gana
dos electrones, tendrá un exceso de dos cargas negativas. Se expresa así
S + 2 electrones -> S-2
Cuando un átomo pierde electrones, queda con exeso de carga positiva y
se llama ion positivo o catión. Si el
litio Li que tiene tres protones y tres electrones pierde un electrón, tendrá
un exceso de una carga positiva y se expresa así:
Li – 1 electron ->Li+
Tipos de enlace químico
Existen diferentes tipos de enlace químico, basados todos ellos, como se ha explicado antes en la estabilidad especial de la configuración electrónica de los gases nobles, tendiendo a rodearse de ocho electrones en su nivel más externo. Este octeto electrónico puede ser adquirido por un átomo de diferentes maneras, en función de la electronegatividad:
- Enlace iónico
- Enlace covalente
- Enlace metálico
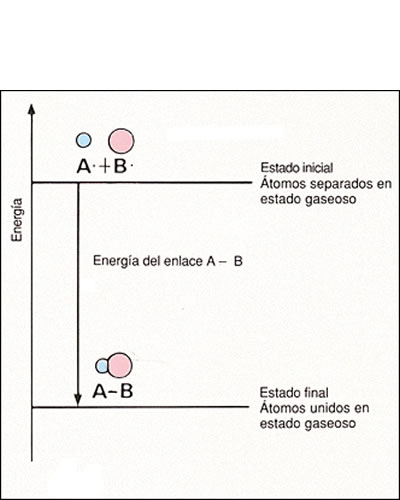 Energía de enlace
Energía de enlaceLa energía de enlace (EE) es la energía total promedio que se desprendería por la formación de un mol de enlaces químicos, a partir de sus fragmentos constituyentes (todos en estado gaseoso), alternativamente, podría decirse también que es la energía total promedio que se necesita para romper un mol de enlaces dado (en estado gaseoso). Los enlaces más fuertes, o sea los más estables, tienen energías de enlace grandes. Los enlaces químicos principales son: enlaces covalentes, metálicos e iónicos.
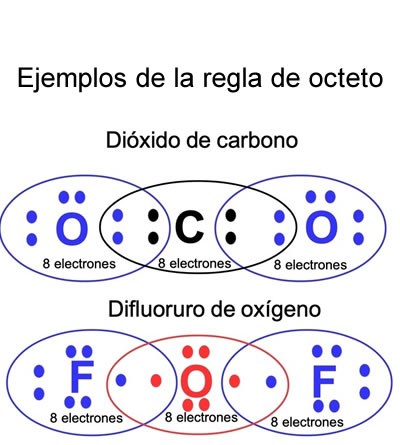 Regla del octeto
Regla del octetoLa regla del octeto consiste en arreglar los átomos de una molécula de forma tal que cada uno está rodeado por ocho electrones.
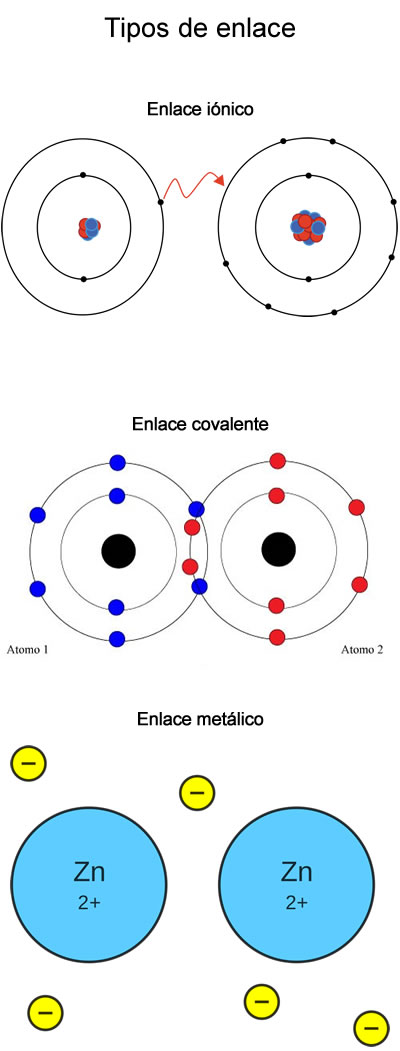 Tipos de enlace químico
Tipos de enlace químico