Descripción de la tabla periódica
Los elementos del sistema períodico se pueden clasificaren tres grandes grupos, gases nobles, metales y no metales.
Tipos de elementos en la tabla periódica
En la tabla periódica, es posible identificar y clasificar a los elementos en 3 grandes grupos: los metales, no metales y metaloides. Podemos encontrar a todos los elementos descubiertos de forma ascendente de su número atómico y organizados en periodos y grupos. Las propiedades de los elementos van cambiando a lo largo de los periodos, cuando un período termina e inicia otro las propiedades se repiten, así consecutivamente. Debido a esto algunos períodos tienen nombres particulares, como los metales alcalinos, alcalinotérreos, halógenos y gases nobles.
Bloques de la tabla periódica
La tabla periódica se puede también dividir en bloques de acuerdo a la secuencia en la que se llenan las capas de electrones de los elementos. Cada bloque se denomina según el orbital en el que en teoría reside el último electrón: s, p, d y f.
- Bloque s El bloque s comprende los dos primeros grupos (metales alcalinos y alcalinotérreos), así como el hidrógeno y el helio.
- Bloque p El bloque p comprende los últimos seis grupos ,que son grupos del 13 al 18 y contiene, entre otros elementos, todos los metaloides.
- Bloque d El bloque d comprende los grupos 3 a 12 y contiene todos los metales de transición.
- Bloque f El bloque f, a menudo colocado por debajo del resto de la tabla periódica, no tiene números de grupo y se compone de lantánidos y actínidos.
Podría haber más elementos que llenarían otros orbitales, pero no se han sintetizado o descubierto; en este caso se continúa con el orden alfabético para nombrarlos. Así surge el bloque g, que es un bloque hipotético.
Principales grupos del sistema periódico
A las columnas verticales de la tabla se las conoce como grupos o familias. Hay 18 grupos en la tabla periódica estándar. En virtud de un convenio internacional de denominación, los grupos están numerados de 1 a 18 desde la columna más a la izquierda —los metales alcalinos— hasta la columna más a la derecha —los gases nobles.
La explicación moderna del ordenamiento en la tabla periódica es que los elementos de un grupo poseen configuraciones electrónicas similares y la misma valencia, entendida como el número de electrones en la última capa. Dado que las propiedades químicas dependen profundamente de las interacciones de los electrones que están ubicados en los niveles más externos, los elementos de un mismo grupo tienen propiedades químicas similares y muestran una tendencia clara en sus propiedades al aumentar el número atómico.
En un mismo grupo se situan los elementos con propiedades químicas semejantes.
- Grupo 1. Metales alcalinos Los metales alcalinos son estos seis elementos químicos: litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr). Estos elementos, junto con el hidrógeno (que es un gas), constituyen el grupo 1 que se encuentra en el bloque-s de la tabla periódica.
- Grupo 2 (II A): Metales alcalinotérreos Los metales alcalinotérreos son los siguientes: berilio (Be), magnesio (Mg), calcio (Ca), estroncio (Sr), bario (Ba) y radio (Ra). Este último no siempre se considera, pues tiene un tiempo de vida media corto. Todos ellos tienen dos electrones en su capa más externa.
- Grupo 3 (III B): familia del escandio (tierras raras y actínidos) este grupo contiene los cuatro elementos escandio (Sc), itrio (Y), lutecio (Lu), y Laurencio (Lr). Ninguno de ellos tiene ninguna función biológica.
- Grupo 4 (IV B): familia del titanio El grupo 4 de la tabla periódica lo comprenden los elementos químicos titanio (Ti), circonio (Zr) y hafnio (Hf), así como el elemento rutherfordio (Rf).
- Grupo 5 (V B): familia del vanadio contiene vanadio (V), niobio (Nb), tantalio (Ta) y dubnio (Db). El cuarto elemento, el dubnio, ha sido sintetizado en laboratorios, pero no se ha encontrado que ocurra en la naturaleza, siendo la vida media del isótopo más estable, el dubnio-268, de solo 29 horas, y otros isótopos aún más radiactivos.
- Grupo 6 (VI B): familia del cromo Sus miembros son el cromo (Cr), molibdeno (Mo), wolframio (también denominado Tungsteno) (W) y seaborgio (Sg). Todos ellos son metales de transición y el cromo, el molibdeno y el tungsteno son metales refractario.
- Grupo 7 (VII B): familia del manganeso El grupo 7 de la tabla periódica lo comprenden los elementos manganeso (Mn), tecnecio (Tc), renio (Re) y bohrio (Bh).
- Grupo 8 (VIII B): familia del hierro El grupo 8 comprende los elementos como Hierro (Fe) ,Rutenio (Ru) , Osmio (Os) , Hassio (Hs) . En los niveles electrónicos externos de estos elementos hay 8 electrones, aunque el hierro no alcanza el estado de oxidación +8. El hassio se produce sólo en el laboratorio, no se encuentra en la naturaleza, y al referirse al grupo 8 se suele obviar este elemento.
- Grupo 9 (VIII B): familia del cobalto Los elementos del grupo 9 son Cobalto (Co) , Rodio (Rd) , Iridio (Ir), Meitnerio (Mt) A temperatura ambiente todos son sólidos. El Meitnerio es sintéticos y no está en la naturaleza.
- Grupo 10 (VIII B): familia del níquel Los elementos del grupo 10 son Níquel (Ni), Paladio (Pd) , Platino (Pt) y Darmstadtio (Ds) a temperatura ambiente todos son sólidos. Todos estos elementos tienen completados los números"d" de su capa de valencia lo que explica su relativa inercia frente a los agentes oxidantes que se hace más patente bajando en el grupo. Todos son metales importantes en ingeniería aeroespacial y en la industria química dada sus propiedades catalíticas.
- Grupo 11 (I B): familia del cobre Este grupo comprenden los elementos cobre (Cu), plata (Ag), oro (Au), roentgenio (Rg). Los tres metales son denominados "metales de acuñar", son relativamente inertes y difíciles de corroer. De hecho los tres existen en forma de elemento en la corteza terrestre y no se disuelven en ácidos no oxidantes y en ausencia de oxígeno. Se han empleado ampliamente en la acuñación de monedas, y de esta aplicación proviene el nombre de metales de acuñar.
- Grupo 12 (II B): familia del zinc es un grupo de elementos químicos de la tabla periódica que incluye el zinc (Zn), el cadmio (Cd) y el mercurio (Hg). Varios experimentos sobre átomos individuales de copernicio (Cn)
- Grupo 13 (III A): térreos El primer elemento es el boro(B) los otros elementos que comprenden este grupo son: aluminio (Al), galio (Ga), indio (In), talio(Tl), y Nihonio (Nh)
- Grupo 14 (IV A): carbonoideos Este grupo está formado por los siguientes elementos Carbono (C), Silicio (Si) , Germanio (Ge), Estaño (Sn) , Plomo (Pb), Flerovio (Fl)
- Grupo 15 (V A): nitrogenoideos Los elementos más importantes de este grupo el Nitrógeno (N), que en su forma diatómica es el componente principal del aire, y el Fósforo (P) que, como el nitrógeno, es esencial para todas las formas de vida conocidas otros elementos del grupo son , Arsénico (As), Antimonio (Sb), Bismuto (Bi) y el elemento sintético Moscovio (Mc).
- Grupo 16 (VI A): calcógenos o anfígenos El grupo de los anfígenos es también llamado familia del oxígeno y tiene los siguientes elementos Oxígeno (O), Azufre (S), Selenio (Se), Teluro (Te), Polonio (Po) y Livermorio (Lv). El nombre de anfígeno en español deriva de la propiedad de algunos de sus elementos de formar compuestos con carácter ácido o básico. Los elementos no metálicos del grupo (oxígeno, azufre, selenio y teluro) también se conocen como calcógenos. Aunque todos ellos tienen seis electrones de valencia sus propiedades varían de no metálicas a metálicas en cierto grado, conforme aumenta su número atómico. El oxígeno y el azufre se utilizan abiertamente en la industria y el telurio y el selenio en la fabricación de semiconductores.
- Grupo 17 (VII A): halógenos Los halógenos del griego, formador de sales son los elementos químicos que forman el grupo 17 de la tabla periódica los elementos son Flúor (F), Cloro (Cl), Bromo (Br), Yodo (I), Astato (At) y Teneso (Ts). Este último también está en los metales del bloque f.
- Grupo 18 (VIII A): gases nobles Los gases nobles son un grupo de elementos químicos con propiedades muy similares por ejemplo, bajo condiciones normales, son gases monoatómicos inodoros, incoloros y presentan una reactividad química muy baja. Se sitúan en el grupo 18 de la tabla periódica. Los siete gases son Helio (He), Neón (Ne), Argón (Ar), Kriptón (Kr), Xenón (Xe), el radiactivo Radón (Rn) y el sintético Oganesón (Og). Las propiedades de los gases nobles pueden ser explicadas por las teorías modernas de la estructura atómica a su capa electrónica de electrones valentes se la considera completa, dándoles poca tendencia a participar en reacciones químicas, por lo que solo unos pocos compuestos de gases nobles.
Elementos descubierto recientemente
Los elementos recientemente descubiertos tienen una vida tan corta que no llega al segundo. Todos ellos se han obtenido artificialmente en los laboratorios. También hay que destacar que los que se han encontrado son tan solo átomos asilados. Se duda incluso de si en realidad se trata de átomos nuevos o de estados transitorios de las uniones de otros átomos ya existentes. Para producir estos átomos se logran haciendo colisionar los núcleos de dos átomos, teniendo lugar una reacción nuclear.
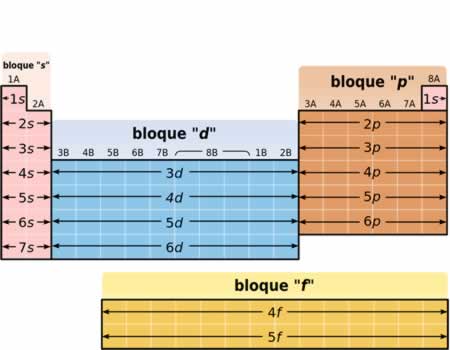 Estructura de los bloques de la Tabla Periódica de los Elementos
Estructura de los bloques de la Tabla Periódica de los ElementosLa tabla periódica está organizada y subdividida en cuatro bloques dependiendo del último orbital de la configuración electrónica. Estos bloques se denominan:
- Bloque s: en estos elementos el nivel energético más externo corresponde a orbitales s
- Bloque p: en estos elementos el nivel energético más externo corresponde a orbitales p
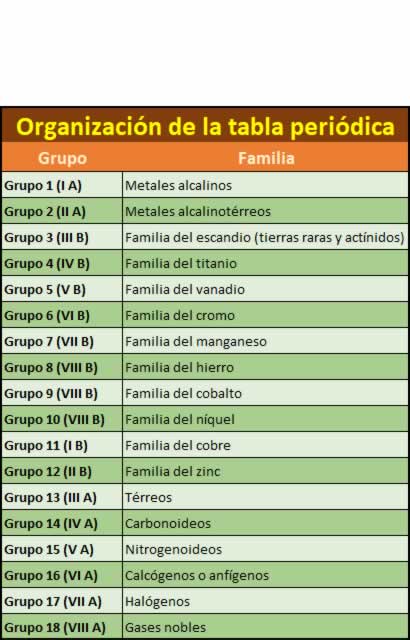 Grupos de la tabla periódica
Grupos de la tabla periódicaLas 18 columnas verticales conforman los conocidos como grupos de la tabla periódica y son elementos que tienden a tener propiedades químicas similares. por ejemplo, la columna más a la izquierda de la tabla, la conocida como el grupo de los metales alcalinos, contiene elementos como el sodio, el potasio o el litio, todos ellos sólidos a temperatura ambiente, con puntos de fusión bajos, muy reactivos y con tendencia a ennegrecerse en contacto con el aire. Su nomenclatura ha cambiado, tanto a lo largo del tiempo como de los países donde se nombren.
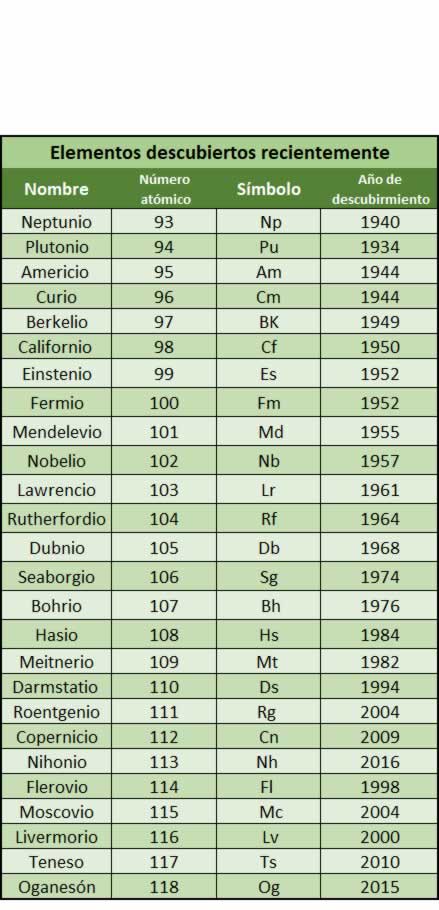 Elementos químicos descubiertos en laboratorios en los últimos años.
Elementos químicos descubiertos en laboratorios en los últimos años.