Número atómico y masa atómica
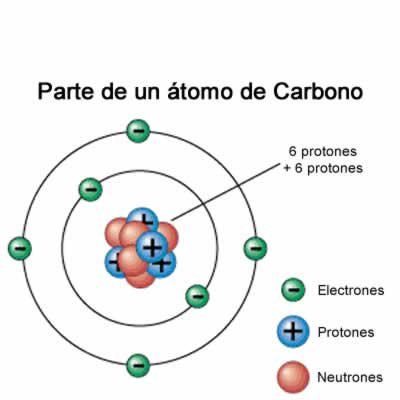
En los distintos modelos atómicos, los átomos se diferencian entre sí por el número de protones, neutrones y electrones que contienen. Para identificar el número de estas partículas se determinan el número másico y el número atómico.
El número másico y el número atómico
Un átomo suele definirse mediante dos números:
- Número atómico es el número de protones que tiene un átomo, como un átomo es neutro el número de protones coincide con el número de electrones, es representado por la letra Z.
Z = número de protones = número de electrones
- Número másico es el número de partículas que tiene un átomo en su núcleo y es la suma de protones y neutrones , es representado por la letra A.
A = número de protones + número de neutrones
La relación existente entre ellos es
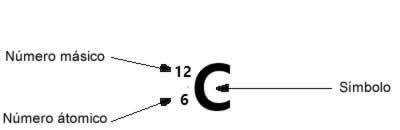
Número másico (A) = número atómico (Z) + número de neutrones(N)
El valor del número másico (A) es útil, pero no nos dice de que elemento se trata . lo que realmente identifica un átomo de cada elemento es el número atómico (Z) pues nos da el número de protones de cada elemento.
Representación abreviada de los atómos
A cada clase de átomo diferente se lo llama elemento químico, pero como sabemos si dos átomos son lo mismo o de diferente elemento, si dos átomos tiene el mismo número atómico, esto es el mismo número de protones en su núcleo, podemos afirmar que son el mismo elemento, por lo tanto lo que define a cada elemento es el número atómico.
Para indicar los números atómico y másico de un elemento de manera abreviada se suele representar el número atómico como un subíndice a la izquierda del símbolo y el número másico como un superíndice también la izquierda.
Tamaño de los átomos
El angstrom vale 0,00000000001 m (10-10 m) con esta unidad se miden los radios nuclear y átomico.
- El radio atómico identifica la distancia media entre dos núcleos de un mismo elemento enlazados entre sí. Por medio del radio atómico es posible determinar el tamaño del átomo.
- Radio nuclear El tamaño de un núcleo atómico.Distintas experiencias han permitido medir el tamaño de los átomos. Considerado como una esfera, el átomo tiene un radio de unos 10-10 m y el núcleo tiene un radio de unos 10-14 m. De aquí se puede deducir que el núcleo es unas 10000 veces más pequeño que el átomo.
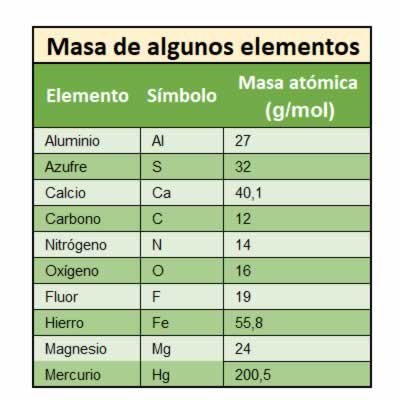
La masa atómica
Ya hemos identificado el número de partículas de un átomo, pero podemos conocer su masa y como se puede medir. Expresar las masas de los átomos en gramos no parece útil, ya que es una unidad muy grande para una partícula tan pequeña, por eso se definió una nueva unidad, la unidad de masa atómica (u).
La unidad de masa atómica (u) equivale a la doceava parte (1/12) de la masa de un átomo de carbono-12. La unidad de masa atómica prácticamente la masa de un protón.
Ionización
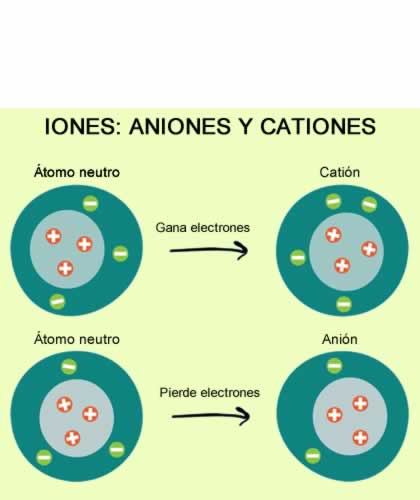
La ionización es el fenómeno químico o físico mediante el cual se generan iones, estos son átomos o moléculas cargadas eléctricamente debido al exceso o deficiencia de electrones de acuerdo a un átomo o molécula neutra. A la especie química con más electrones que el átomo o molécula neutros se le llama anión, y posee una carga neta negativa, y a la que tiene menos electrones catión, teniendo una carga neta positiva. Hay varias maneras por las que se pueden formar iones de átomos o moléculas.
¿Como se forma un ion?
La parte más extrema y voluminosa del átomo la determinan los electrones. Es lógico pensar que para formar un ion a partir de un átomo sea el número de electrones lo que varíe.
- Para formar un ion negativo o anión, un átomo debe tomar algún electrón del entorno, así tendrá más cargas negativas que positivas, más electrones que protones y, por lo tanto no será neutro. Si toma un electrón, se formará un anión con una carga negativa o monovalente, si toma dos tendra dos cargas negativas y sera divalente en general.
- Para obtener un ion positivo o cation, unátomo debe perder algún electrón , así tendrá más cargas positivas que negativas, más protones que electrones y, por lo tanto no será neutro. Si pierde un electrón, se formará un catión con una carga positiva o monovalente, si pierde dos electrones tendra dos cargas positivas y sera divalente en general.
Los iones se representan con el mismo símbolo que el elemento del qie provienen indicando el número de cargas y el signo de estas con un superindice a la derecha. Asi por ejemlo, el ion yoduro I -, tiene una carga negativa por tener un electrón de más, mientras que el ion Ca2+ tiene dos cargas positivas por tener dos electrones de menos.