Disolución
Una disolución es una mezcla homogénea formada por dos o más sustancias puras que no reaccionan químicamente entre si. El agua de mar , la sangre , el bronce , el latón o el aire que inspiramos todas estos son disoluciones.
Una de estas sustancias es el disolvente y la otra (o las otras) es el soluto. La distinción entre soluto y solvente es un poco arbitraria, pero por lo general se toma el soluto como el componente que está en menor cantidad y el solvente como el componente que está en mayor cantidad en la disolución.
Cuando se forma una disolución, el soluto (minoritario) pasa a formar parte del solvente (mayoritario) en la disolución, modificando así las propiedades físicas de cada componente puro por separado, como el punto de ebullición o congelación, pero sin alterar las propiedades químicas de cada uno.
| Masa disolución = masa disolvante + masa soluto |
El resultado obtenido, de hecho, depende en gran medida de la concentración de soluto y especialmente de su coeficiente de solubilidad (cantidad necesaria de una sustancia para saturar cierta cantidad de solvente) en el solvente (algunas sustancias se disuelven mejor en otras).
Las disoluciones se clasifican según el estado de agregación de sus componentes, en:
- Cuando el soluto y el disolvente son sólidos. Disoluciones de sólido en sólido. Las aleaciones son un ejemplo de este tipo de disolución. Por ejemplo: el bronce es una aleación de cobre (Cu) y estaño (Sn).
- Cuando el soluto es un sólido y el disolvente es un líquido. Disoluciones de sólido en líquido. Son probablemente las más empleadas en todas las ramas de la química y otros rubros. Por ejemplo: una disolución de agua con sal.
- Cuando el soluto es un sólido y el disolvente es un gas. Disoluciones de sólido en gas. Por ejemplo: el polvo disuelto en el aire.
- Cuando el soluto es un líquido y el disolvente es un sólido. Disoluciones de líquido en sólido. Por ejemplo: las amalgamas son una disolución de mercurio líquido y plata sólida, o mercurio y otros metales.
- Cuando el soluto es un líquido y el disolvente es un líquido. Disoluciones de líquido en líquido. Son también muy empleadas en todos los rubros de la química, la medicina y la industria en general. Por ejemplo, una disolución de etanol en agua.
- Cuando el soluto es un líquido y el disolvente es un gas. Disoluciones de líquido en gas. Por ejemplo: el aire o algún otro gas húmedo.
- Cuando el soluto es un gas y el disolvente es un sólido. Disolución de un gas en sólido. Por ejemplo: disolución de hidrógeno en algunos metales.
Componentes de una disolución
Cuando el soluto es un gas y el disolvente es un líquido. Disolución de un gas en líquido. Por ejemplo: el oxígeno disuelto en agua, que permite la respiración de los peces.
Cuando el soluto es un gas y el disolvente es un gas. Disolución de un gas en gas. Por ejemplo: el gas natural es una disolución gaseosa de metano, etano, propano, butano, dióxido de carbono y otros gases en pequeñas proporciones.
Las disoluciones tienen dos componentes diferentes:
- Disolvente. El disolvente es la sustancia en la que se disuelve el soluto, generalmente es la más predominante. También se le conoce como solvente, dispersante o medio de dispersión.
- Soluto(s). En este caso hablamos de la sustancia que es disuelta por el disolvente. Una misma disolución puede tener más de un soluto disuelto en en el mismo disolvente. El soluto se encuentra en menor cantidad que el disolvente.
Propiedades de una disolución
Los componentes de una disolución no pueden ser reconocidos a simple vista. Tampoco pueden ser separados por centrifugación, ni filtración, sino por métodos fraccionarios de separación de fases, como son la evaporación, la destilación o la cristalización. Esto se debe a que se trata de una mezcla homogénea, en la que no se dan reacciones químicas, pero sí se obtiene un resultado distinto en apariencia y propiedades físicas a sus sustancias antecesoras.
Su comportamiento físico es distinto al de sus componentes por separado pero, por el contrario, dejan sin alterar las propiedades químicas de cada uno. Tal como en otras mezclas, podemos también obtener diversos tipos de disoluciones (y con ellas, distintos comportamientos) a través de la concentración final del soluto en el solvente, pudiendo así hablar de:
- Disoluciones diluidas. Poco soluto en la misma cantidad de disolvente.
- Disoluciones concentradas. Abundante soluto en la misma cantidad de disolvente.
- Disoluciones saturadas. Logran el equilibrio entre soluto y disolvente, sin que se pueda añadir más soluto, al menos en ciertas condiciones dadas de temperatura y presión.
- Disoluciones sobresaturadas. Son disoluciones que contienen más soluto del que tendría la disolución saturada a cierta temperatura y presión. Si se aumenta la temperatura de una disolución saturada, es posible agregar más soluto, pero si se deja enfriar lentamente, se puede transformar en una disolución sobresaturada.
Solubilidad
La solubilidad es la capacidad de una sustancia de disolverse en otra llamada disolvente. También hace referencia a la masa de soluto que se puede disolver en determinada masa de disolvente, en ciertas condiciones de temperatura, e incluso presión (en caso de un soluto gaseoso). La solubilidad la podemos encontrar en diferentes mezclas como por ejemplo en el ion común es muy difícil encontrar ya que el ion común es principal en la solubilidad. Si en una disolución no se puede disolver más soluto se dice que la disolución está saturada. Bajo ciertas condiciones la solubilidad puede sobrepasar ese máximo y pasa a denominarse solución sobresaturada. Por el contrario, si la disolución admite aún más soluto, se dice que se encuentra insaturada.
No todas las sustancias se disuelven en un mismo solvente. Por ejemplo, en el agua, se disuelve el alcohol y la sal, en tanto que el aceite y la gasolina no se disuelven en agua. En la solubilidad, el carácter polar o apolar de la sustancia influye mucho, ya que, debido a este carácter, la sustancia será más o menos soluble; por ejemplo, los compuestos con más de un grupo funcional presentan gran polaridad por lo que no son solubles en éter etílico. Los compuestos poco reactivos, como las parafinas, compuestos aromáticos y los derivados halogenados tienen menor solubilidad.
El término solubilidad se utiliza tanto para designar al fenómeno cualitativo del proceso de disolución como para expresar cuantitativamente la concentración de las soluciones. La solubilidad de una sustancia depende de la naturaleza del solvente y del soluto, así como de la temperatura y la presión del sistema.
Solubilidad y temperatura
La solubilidad de un soluto en un determinado solvente principalmente depende de la temperatura. Para muchos sólidos disueltos en el agua líquida, la solubilidad aumenta con la temperatura hasta 100 °C, aunque existen casos que presentan un comportamiento inverso. En la mayoría de los casos en el agua líquida a altas temperaturas la solubilidad de los solutos iónicos tiende a aumentar debido al cambio de las propiedades y la estructura del agua líquida, que reduce la constante dieléctrica de un disolvente menos polar.
Los solutos gaseosos muestran un comportamiento más complejo con la temperatura. Al elevarse la temperatura, los gases generalmente se vuelven menos solubles en agua (el mínimo que está por debajo de 120 °C para la mayoría de gases), pero más solubles en solventes orgánicos.
Cristalización
La cristalización es un proceso físico por el cual se forma un sólido, el cristal, a partir de un gas, un líquido o una disolución, en el que los iones, átomos o moléculas están altamente organizados, al establecerse enlaces formando una red cristalina. La cristalización se emplea con bastante frecuencia en química para purificar una sustancia sólida.
La cristalización se produce en dos pasos principales. El primero es la nucleación, la aparición de una fase cristalina a partir de un líquido sobreenfriado o de un solvente supersaturado. El segundo paso se conoce como crecimiento cristalino, que es el aumento en el tamaño de las partículas y conduce a un estado cristalino. Una característica importante de este paso es que las partículas sueltas forman capas en la superficie del cristal y se alojan en inconsistencias abiertas como poros, grietas, etc.
La mayoría de minerales y moléculas orgánicas cristalizan fácilmente, y los cristales resultantes son generalmente de buena calidad, es decir, sin defectos visibles. Sin embargo, las partículas bioquímicas más grandes, como las proteínas, son a menudo difíciles de cristalizar. La facilidad con la que las moléculas cristalizarán fuertemente depende de la intensidad de las fuerzas atómicas (en el caso de sustancias minerales), fuerzas intermoleculares (sustancias orgánicas y bioquímicas) o fuerzas intramoleculares (sustancias bioquímicas).
La cristalización es también una técnica de separación química sólido-líquido, en la que se produce la transferencia de masa de un soluto de la solución líquida a una fase cristalina sólida pura. En ingeniería química, la cristalización ocurre en un cristalizador. La cristalización está por tanto relacionada con la precipitación, aunque el resultado no es amorfo o desordenado, sino un cristal.
 Una vez que se produce la disolución, el soluto no puede distinguirse del solvente.
Una vez que se produce la disolución, el soluto no puede distinguirse del solvente. El agua caliente es el solvente necesario para preparar el café.
El agua caliente es el solvente necesario para preparar el café. El acero es carbono disuelto en hierro.
El acero es carbono disuelto en hierro.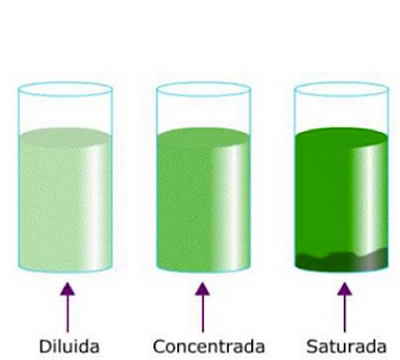 La solubilidad de un soluto en una disolución pueden ser diluidas , concentradas o saturadas
La solubilidad de un soluto en una disolución pueden ser diluidas , concentradas o saturadas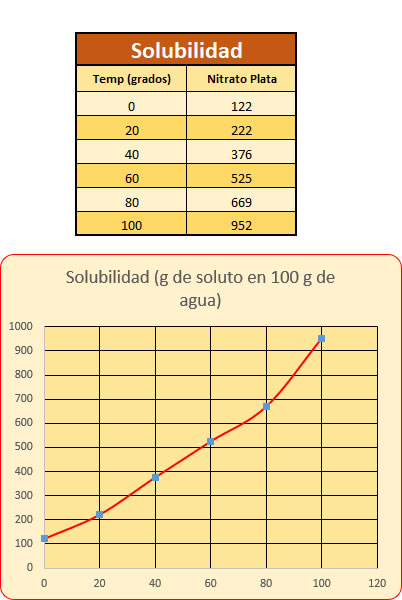 Curva de solubilidad del nitrato de plata (AgNO3)
Curva de solubilidad del nitrato de plata (AgNO3) Cristalización .La cristalización mediante procesos químicos pretende separar las partículas de las sustancias líquidas para lograr obtener dos elementos que puedan ser analizados independientemente
Cristalización .La cristalización mediante procesos químicos pretende separar las partículas de las sustancias líquidas para lograr obtener dos elementos que puedan ser analizados independientemente