Electricidad y materia
Muchos fenómenos muestran la relación entre la constitución de la materia y la electricidad.
- Algunos cuerpos al ser frotados adquiren carga eléctrica
- La corriente eléctrica descompone algunas sustancias en otras más simples (electrólisis).
A partir de estas evidencias se empezó a estudiar la naturaleza eléctrica de la materia, la primer partícula que se descubrió fue el electron, en 1897 el físico Thompson demostró con experiencias basadas en tubos de vidrio y grandes descargas eléctricas la emisión de partículas cargadas negativamente, a los constituyentes de estas partículas se los denominó eletrones.
Esta partícula de masa tan pequeña que se considera despreciable y carga eléctrica negativa, permitió explicar el comportamiento eléctrico de la materia que, curiosamente, ya habián postulado los griegos dos mil años antes.
Por lo tanto se reviso la teoria de Dalton de principios del siglo XIX que sostenía que el átomo era indivisible. Si el átomo era eléctricamente neutro y en su interior habia cargas negativas, tendria que haber tambien cargas positivas para neutralizarlas.
Es así que en 1911 Ernest Rutherford descubrio la partícula positiva constituyente de la materia y la llamo protón, su masa esta dos mil veces mayor a la del elentrón y tenía la misma carga pero de signo positivo.
Podemos concluir que la materia está constituida por átomos que a su vez los átomos estan compuestos por electrones y protenes en igual cantidad lo que produce que el atٴómo sea electricamente neutro.
Ahora bien dato que los electectrones tienen masa despreciable, solo con los proteones no se consigue toda la masa atómica. ¿De dónde procede por lo tanto, el resto de la masa del átomo.? Se hace necesaria la existencia de otra partícula subatómica , fue en 1932 cuando Chadwick descubrio el neutrón una partícula con masa apreciable y sin carga eléctrica.
Nuevas partículas
Aunque en general se trabaja con las tres partículas antes mencionadas (electrón , neutón, y protón en los últimos años continúo la subdivisión.
En 1964 Murray Gell-Mann y George Zweig propusieron la teoría de los quarks , esta considera que la materia son dos docenas de partículas que pueden agruparse en dos familias los leptones y los quarks.
Distribucion de partículas para construir un átomo
Una vez descubiertas las partículas, los científicos se concentraron en explicar como se distribuian estas para contituir un átomo y para ellos buscaron un modelo atómico.El primer modelo lo propuso en 1904 Thompson.Si bien el modelo de Thomson explicaba adecuadamente muchos de los hechos observados de la química y los rayos catódicos, hacía predicciones incorrectas sobre la distribución de la carga positiva dentro de los átomos. Las predicciones del modelo de Thomson resultaban incompatibles con los resultados del experimento de Rutherford que años despues en 1911 presento un nuevo modelo atómico o la estructura interna del átomo Rutherford llegó a la conclusión de que la masa del átomo se concentraba en una región pequeña de cargas positivas que impedían el paso de las partículas alfa. Más tarde propuso un nuevo modelo atómico que poseía un núcleo o centro en el que el Modelo atómico de Thomson no pudo explicar cómo se mantiene la carga en los electrones dentro del átomo.Tampoco pudo explicar la estabilidad de un átomo. La teoría no mencionó nada sobre el núcleo del átomo esto ha ido evolucionando hasta la actualidad donde el modelo de nube de carga o modelo atómico ondulatorio.
Espectros atómicos
Durante el siglo XIX se habían observado los espectros de absorción y emisión de diversas sustancias. Estos consisten en una serie de líneas que corresponden a unas frecuencias determinadas para las cuales la radiación electromagnética es absorbida o emitida. Este conjunto de frecuencias es característico de cada sustancia. Es como un código de barras que permite identificar la presencia de una sustancia tanto en un material en el laboratorio como en una estrella lejana. Dichos espectros fueron asociados a la estructura atómica. Puesto que los distintos elementos se diferencian en última instancia en los átomos que los componen, los espectros deben ser característicos de dichos átomos y por tanto emitidos por éstos (en realidad también hay espectros moleculares).
Cuando un elemento en estado gaseoso se calienta o se “excitan” por medio de una descarga eléctrica, emite luz., ya se sabía que toda emisión de luz proviene de acelerar un cargas eléctricas, luego en el interior de los atómos debía haber una carga eléctrica que de alguna manera, se acelerase cuando se excitara un elemento gaseoso mediante algún procedimiento. Por otra parte si esa luz emitida se la hacia pasar por un prisma se descomponia en radiación luminosa de diferentes colores que podian recogerse en una pantalla en forma de rayas luminosas de distinta intensidad y grosor.
Según el elemento químico con el que estemos trabajando, aparecen uno o otros colores por lo que el conjunto de rayas (colores) se le denomina espectro de emision de dicho elemento. Asi por ejemplo, el de sodio gaseoso se caracteriza por dos finas líneas amarillas intensas y muy juntas mientras que el vapor de hierro incandescente esta formado por mas de 6000 líneas brilantes. La existencia de un espectro característico para cada elemento hacia pensar en cargas eléctricas en el interior de los átomos organizados de forma diferente según el elemento de que se trate.
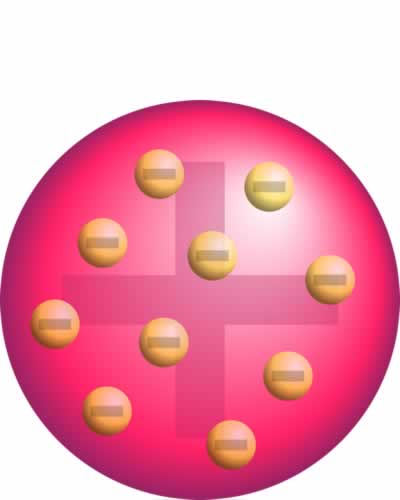 Modelo atómico de Thomson
Modelo atómico de Thomson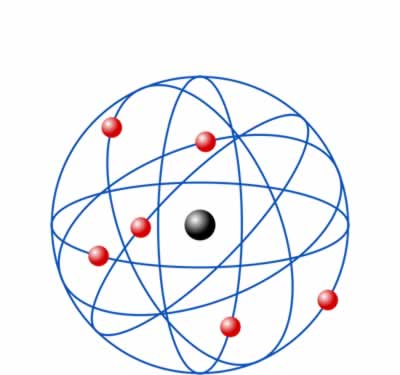 Modelo atómico de Rutherford
Modelo atómico de Rutherford