Modelo atómicos
El experimento de Thompson
En 1897 J.J. Thompson demostro la existencia de partículas cargadas negativamente que eran los electrones, ademas determino la relación entre la carga y la masa de los electrones, demostrando que esta relacion era constante e independiente del material utilizado Para ello realizo un experimento donde en los extremos de una ampolla de vidrio, en la que se ha hecho el vacío, se sitúan dos placas metálicas (electrodos, cátodo y ánodo) . Si entre ellas se crea una diferencia de voltaje eléctrico suficientemente elevada, se produce una descarga. Si disponemos a lo largo del eje de la descarga una superficie de sulfuro de zinc, veremos que la superficie muestra un rayo luminoso (rayos catódicos). Este rayo está formado por partículas de carga negativa porque en presencia de un campo eléctrico, el rayo se desvía hacia el polo positivo (ánodo en la figura superior). Las partículas son los electrones que poseen una cierta masa y una carga negativa. Aplicando campos eléctricos y magnáticos a los rayor catódicos, Thomson fue capaz de medir la relación masa/carga del electrón.
El modelo de Thompson
Thompson, después de medir las características del electrón intuyó la existencia de carga positiva en el átomo dada la neutralidad de la materia, entonces propuso un modelo que consistía en una esfera maciza cargada positivamente, en la que se hallan incurstados electrones con carga negativa, A menudo llamamos modelo de budín de pasas del átomo a este modelo, debido al hecho de que su descripción es muy similar a un budín de pasas, un postre inglés muy popular.
Dado lo que ahora sabemos de la estructura real de los átomos, este modelo puede sonar un poco descabellado. Afortunadamente, los científicos continuaron investigando la estructura del átomo, y pusieron a prueba la validez del modelo del budín de pasas de Thomson.
Experiencia de Rutherford
El siguiente experimento revolucionario en la historia del átomo lo realizó Ernest Rutherford, un físico neozelandés que pasó gran parte de su carrera en Inglaterra y Canadá. En su famoso experimento de la lámina de oro, Rutherford disparó un rayo delgado de partículas \alphaαalpha (se pronuncia partículas alfa) a una fina lámina de oro puro. Las partículas alfa se emiten durante diversos procesos de decaimiento radiactivo. En este caso, Rutherford colocó una muestra de radio (un metal radiactivo) dentro de una caja de plomo con un pequeño agujero. La mayoría de la radiación era absorbida por el plomo, pero un rayo delgado de partículas \alphaαalpha era capaz de escapar del agujero en la dirección de la lámina de oro. La lámina estaba rodeada de una pantalla detectora que destellaba cuando una partícula α (alfa) la golpeaba
Luego del experimento de Rutherford se observó lo siguiente:
- La mayoría de las partículas atravesaba la lámina de oro sin deviarse
- Una pequeña proporción atravesaba la lámina de oro con una ligera desviacióm en su trayectoria.
- Solo una de cada 10.000 partículas rebotaba y no atrvesaba la lámina
El modelo de Rutherford
Basándose en su experimento, Rutherford estableció el siguiente modelo atómico.
- El átomo está formado por un núcleo y una corteza.
- En el nucleo se concentra la carga positiva (protones) y la mayor partes de la carga del átomo.
En la corteza girando alrededor estan los electrones, esta zona ocupa la mayor parte del volumén atómico.
La explicación de este modelo para la experiencia del bombardeo de partículas alfa a una lámina de oro es la siguiente:
- La mayoria de las partículas atravesavan la lámina de oro sin desviarse. Esto es así porque el átomo esta practicamente vacio, solo habia algunos electrones girando alrededor del nucleo y la masa de los electrones es muy pequeña.
- Una pequeña proporción atravesaba la lámina con una ligera desviación en su trayectoria: Las partticulas que se desviaban eran las que pasaban cerca del núcleo se repelián (ambas tienen carga positiva) y sufrían una pequeña desviación.
- Solo una de cada 10000 partículas rebotaba y no atravesaba la lámina. Las partículas que rebotaban eran eran repelidas por el núcleo. El tamaño del núcleo era muy pequeño comparado con el tamaño total del átomo, unas 10.000 veces más pequeño.
Un poco después en 1920 Rutherford propuso la existencia de otra partícula en el nucleo y la denominó neutrón, tendría la massa del protón y carecía de carga. La evidencia experimental de esta partícula no se tuvo hasta 1932 con los experimentos de Chadwick. Este modelo explica perfectamente la experiencia de Rutherford, sin embargo, sería imposible explicar con el modelo de Thompson por que la mayoría de los protones atravesaban la lámina de oro.
El modelo de Bohr
Cuando Rutherford enuncio su modelo no tuvo en cuenta algunos trabajos publicados por sus contemporaneos y que ponian en evidencia ciertos aspectos negativos de su teoría. El principal inconveniente del modelo de Rutherford radica que si los electrones son partículas cargadas que estan girando alrededor de un núcleo , van perdiendo energia y acabarían precipitandose sobre él en un tiempo muy pequeño (una fracción de segundo).
Basándose en algunas experiencias de sus colegas, como el efectofotoeléctico, la teória cuántica de Planck y Einstein según la cual la energía de un sistema no puede aumentar o disminuir en forma continua sino con saltos muy pequeños o “cuantos” de energia. Y los espectros atómicos Niels Bohr propuso un modelo compuesto por nucleo y corteza similar al modelo de Rutherford , pero lo electrones giran en órbitas circulares donde no emiten ni absorben energia, a estas órbitas permitidas se las llamo “Niveles de energía”
El modelo atómico de Bohr partía conceptualmente del modelo atómico de Rutherford y de las incipientes ideas sobre cuantización que habían surgido unos años antes con las investigaciones de Max Planck y Albert Einstein. El modelo atómico de Bohr partía conceptualmente del modelo atómico de Rutherford y de las incipientes ideas sobre cuantización que habían surgido unos años antes con las investigaciones de Max Planck y Albert Einstein.
En este modelo los electrones giran en órbitas circulares alrededor del núcleo, ocupando la órbita de menor energía posible, o la órbita más cercana posible al núcleo. El electromagnetismo clásico predecía que una partícula cargada moviéndose de forma circular emitiría energía por lo que los electrones deberían colapsar sobre el núcleo en breves instantes de tiempo. Para superar este problema Bohr supuso que los electrones solamente se podían mover en órbitas específicas, cada una de las cuales caracterizada por su nivel energético. Cada órbita puede entonces identificarse mediante un número entero n que toma valores desde 1 en adelante. Este número "n" recibe el nombre de número cuántico principal.
Bohr supuso además que el momento angular de cada electrón estaba cuantizado y solo podía variar en fracciones enteras de la constante de Planck. De acuerdo al número cuántico principal calculó las distancias a las cuales se hallaba del núcleo cada una de las órbitas permitidas en el átomo de hidrógeno. Estos niveles en un principio estaban clasificados por letras que empezaban en la "K" y terminaban en la "Q". Posteriormente los niveles electrónicos se ordenaron por números. Cada órbita tiene electrones con distintos niveles de energía obtenida que después se tiene que liberar y por esa razón el electrón va saltando de una órbita a otra hasta llegar a una que tenga el espacio y nivel adecuado, dependiendo de la energía que posea, para liberarse sin problema y de nuevo volver a su órbita de origen.
Perfeccionamiento del modelo atómico de Bohr por Sommerfeld
En 1916, Sommerfeld perfeccionó el modelo atómico de Bohr intentando paliar los dos principales defectos de este. Para eso introdujo dos modificaciones básicas: órbitas casi elípticas para los electrones y velocidades relativistas. En el modelo de Bohr los electrones solo giraban en órbitas circulares.
El modelo actual
El modelo atómico de Bohr es muy útil, pero la ciencia ha evolucionado y las experiencias posteriores llevaron a abandonar la idea de las órbitas estacionarias de Bohr , que se regían según las leyes de la mecánica clásica, para establecer una nueva mecánica , la mecánica cuántica cuyos padres fueron los científicos Werner Heisenberg, Erwin Schrödinger y Paul Dirac.
Se abandono el concepto de órbita estacionaria, debido a que fundamentalmente no se puede determinar con precisión la posición exacya de un electrón en un determinado instante.
En la mecánica cuantica se define el orbital como una zona del espacio donde la probabilidad de encontrar un electrón es máximo.
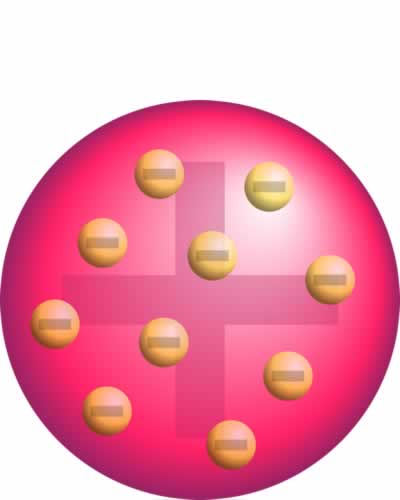 Modelo atómico de Thomson
Modelo atómico de ThomsonEste fue el primer modelo atómico y según él, el átomo era una esfera de masa positiva uniforme, en la que se encontraban insertas las cargas negativas, lo que explicaba la neutralidad eléctrica de la materia.
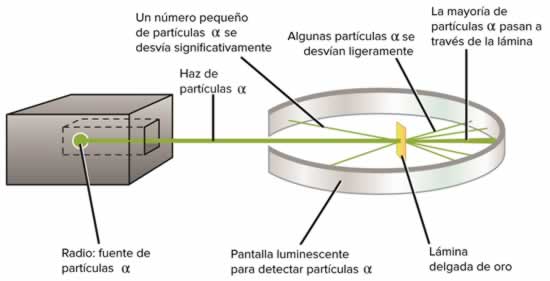 Experimento de Rutherford
Experimento de RutherfordEl experimento de la lámina de oro de Rutherford mostró que los átomos son mayoritariamente espacio vacío, junto con un pequeño y denso núcleo positivamente cargado. Basado en estos resultados, Rutherford propuso el modelo nuclear del átomo.
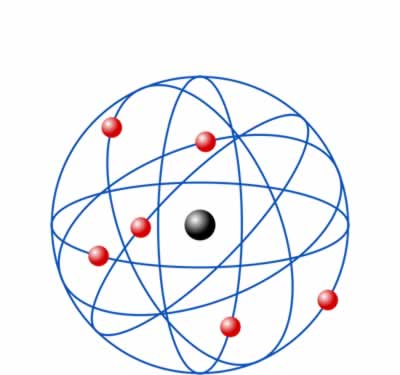 Modelo atómico de Rutherford
Modelo atómico de RutherfordEste modelo constituyó un quiebre con modelos anteriores como el Modelo atómico de Dalton y el modelo atómico de Thompson, y un paso hacia adelante respecto al modelo actualmente aceptado. En su modelo atómico, Rutherford propuso que los átomos tienen un núcleo central donde se encuentra el mayor porcentaje de su masa. Además, según esta teoría, este núcleo tiene carga eléctrica positiva y es orbitado por partículas de carga opuesta y menor tamaño (electrones).
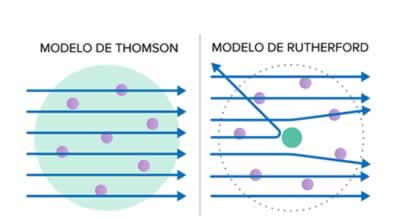 Diferencias entre los Modelos atómicos de Thomson y de Rutherford
Diferencias entre los Modelos atómicos de Thomson y de RutherfordPara Bohr en 1913, la principal diferencia entre los modelos de Rutherford y de Thomson, está en que el segundo permite a los electrones determinadas configuraciones y movimientos, para los cuales el sistema mantiene un equilibrio estable, lo cual aparentemente no existe para el modelo de Rutherford.
