Tabla periódica de los elementos
A medida que el número de elementos químicos conocidos aumentaba, se hacia más necesario este conocimiento de una manera racional. Desde comienzos del siglo XIX , los científicos fueron proponiendo diferentes sistemas para agruparlos de una forma sistemática que faculitara su estudio.
Evolución de la clasificación de los elementos químicos
Las primeras calificaciones de los elementos químicos atendian a criterios puramente alfabéticos o a la diferenciación entre metales y no metales. El primer esquema de clasificación de los elementos lo realizó Berzelius en 1813, el dividio los elementos naturales en dos grandes grupos metales y no metales. Los elementos metálicos eran los que tenían cierto brillo característico, eran maleables y dúctiles, además conducian la electricidad y el calor. Los no metales eran los que tenian diversos aspectos físicos y no conducian el calor y la electricidad.
En 1829, el químico alemán Döbereiner estableció el primer intento de clasificación sistemática de los diferentes elementos químicos, agrupandolos de tres en tres, las llamadas triadas. En estas el elemento central tenia una masa atómica cercana a la media aritmética de la de los extremos, solo pudo ordenar nueve elementos pero su trabajo dio la pista para seguir con las investigaciones.
En el período 1830 y 1860, el químico francés Jean Baptiste Dumas, clasificó a los elementos en metales y metaloides, estableciendo cinco familias H, F, O, N y C. En 1862 el francés Alexander B. de Chancourtois constuyo su “anillo telórico” este ordenamiento dispuso los elementos según el orden creciente de sus pesos atómicos sobre una curva helicoidal en el espacio, de manera que los puntos que se correspondían sobre las sucesivas vueltas de la hélice, diferían en 16 unidades de peso atómico. Los elementos análogos, estaban situados en tales puntos, lo que sugería una repetición periódica de las propiedades.
Entre 1850 y 1865, fueron descubiertos nuevos elementos, haciéndose además grandes avances en la determinación de los pesos atómicos, pudiendo darse valores más acertados y precisos a los pesos atómicos de los elementos ya conocidos, y valores correctos a los recién descubiertos. En 1865, el químico británico john A, Newlands ordenó los elementos en orden creciente de pesos atómicos, observando que el octavo elemento se parecía al primero, el noveno al segundo y así sucesivamente entonces a esta observación se le llama, “Ley de las octavas de Newland”, en honor al químico inglés.
Posteriormente se descubrió una familia de compuestos inertes, formada por el helio, neón, argón, kriptón, y xenón, o lo que es lo mismo, el grupo de los gases nobles. Este descubrimiento transformó a las octavas de Newlands, en novenas. Los esfuerzos de Newlands, supusieron un gran paso con buena dirección, en los que a clasificación de elementos se refería pero, sin embargo, pueden destacarse tres grandes críticas a su esquema clasificatorio:
- No existía un lugar indicado para los elementos recientemente descubiertos.
- No tuvo mucha consideración con los pesos atómicos, ni siquiera realizó una estimación aproximativa de los valores más probables.
Algunos elementos no encajaban en el esquema de Newlands , como por ejemplo , el cromo, que quedaba mal posicionado bajo el aluminio, y el magnesio, que es un metal, venía colocado bajo el fósforo que es un no metal, así como el hierro que tratándose de un metal, se encontraba debajo del azufre (no metálico), así que tanto éstos, como otros elementos, no encajaban de ninguna manera en el esquema.
Esta clasificación, o regla de ordenación, no se cumplía a partir del calcio en adelante. Las tres primeras filas de la tabla de Newlands, en cuanto a puntos de ebullición y fusión, se puede comparar a la tabla periódica actual. El químico alemán J. Lothar Meyer modificó el ordenamiento de los elementos teniendo en cuenta también los volúmenes atómicos, No fue hasta 1870 cuando el químico ruso Mendeléiev que publicó la tabla precursora a la actual que seguia las ideas de Newlands en la disposición de los elementos en orden creciente de los pesos atómicos pero perfeccionada en:
- Si un elemento no encajaba según su peso atómico, dejaba un hueco vacio para un nuevo elemento. Por ejemplo no existia ningún elemento que encajara debajo del silicio. Por lo tanto se dejo un espacio para un nuevo elemento a descubrirse en el futuro a ese espacio lo denominó “ekasilicio” esta nombre fue reemplazado en 1886 cuando se descubrio el Germanio.
- Se llevo a cabo un estudio sobre los pesos atómicos conocidos hasta entonces, realizándose una nueva determinación de los pesos ya conocidos que ofrecian duda sobre su precisión.
- Para evitar la colocación de metales como el vanadio, cromo y magnesio debajo de lo no metales como fosforo, azufre y cloro se formaron períodos largos para los elementos conocidos actualmente como metales de transición.
- Se predijeron las propiedades de los elementos aún sin descubrir, a partir del comporrtamiento repetitivo que periódicamente se observa en la tabla. Un ejemplo muy claro es la comparación de las propiedades predichas para el elemento ekasilicio y las propiedades comprobadas más tarde del elemento germanio, que ocupó el lugar del ekasilicio en la tabla.
Predicciones como esta motivaron que la investigación se dirigiera hacia la búsqueda de nuevos elementos y compuestos, hallándose valores más exactos para las magnitudes físicas (pesos atómicos, densidades,) cuando los datos conocidos no ajustaban bien con los valores presumibles. Aunque la tabla periódica se desarrolló basándose en experimentos, es más sencillo entender su estructura y su periodicidad sobre la base de las configuraciónes electrónicas de los elementos, según los electrones que forman los últimos niveles electrónicos.
El sistema periódico actual
- En la línea horizontal, llamadas períodos, se colocan los elementos en orden creciente de su número atómico.
- En la línea vertical, llamadas grupos o familias se colocan elementos de propiedades semejantes.
Agrupaciones de elementos
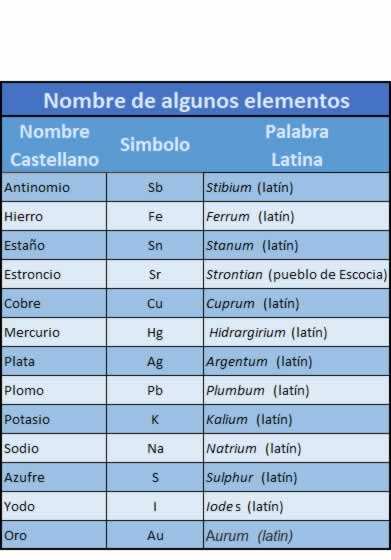
El origen de los símbolos de los elementos
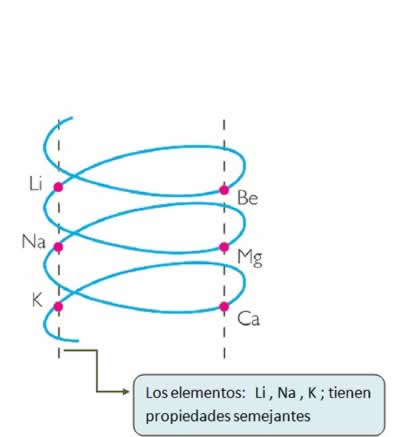 Anillo telúrico de Chancourtois
Anillo telúrico de ChancourtoisConsistía en una hélice en la que los elementos se hallaban dispuestos según un orden creciente de pesos atómicos alrededor de un cilindro. Cada vuelta contenía 16 elementos y el telurio ocupaba el lugar central.
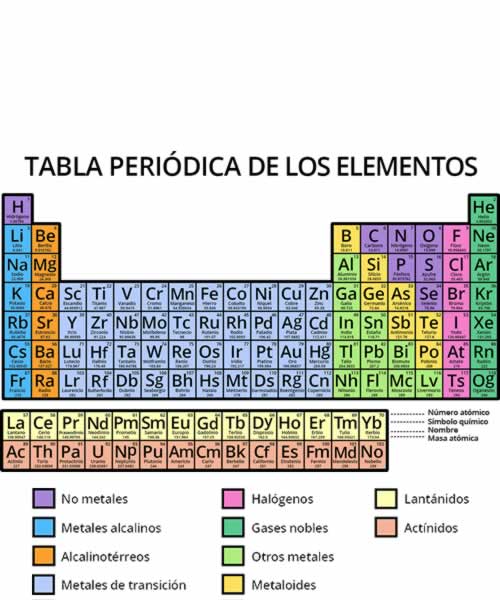 Tabla periodica de los elementos de Mendeléiev
Tabla periodica de los elementos de MendeléievMendeléiev publicó la primera tabla periódica de los elementos atómicos en 1869 basándose en las propiedades que aparecían con cierta regularidad ya que dispuso los elementos ordenados, desde el más ligero al más pesado. Cuando Mendeléyev propuso su tabla periódica, señaló deficiencias en la misma, y predijo que debían existir algunos elementos desconocidos con ciertas propiedades adecuadas para llenar esos vacíos. Los cuatro elementos predichos que eran de menor masa atómica que los elementos de las tierras raras, ekaboro (Eb), ekaaluminio (Ea), ekamanganeso (Em), y ekasilicio (Es), demostraron ser buenos predictores de las propiedades del escandio, galio, tecnecio y germanio respectivamente, y cada uno rellenaba el lugar de la tabla periódica asignado por Mendeléiev.
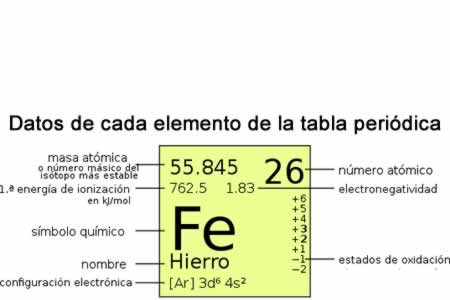 Datos de cada elemento químico
Datos de cada elemento químicoEn la tabla cada casillero corresponde a un elemento químico de la tabla que brinda los datos como masa atómica , la energía de ionización , el símbolo quimico , el nombre , la configuración electrónica , número atómico, electronegatividad, estados de oxidacion.
 Datos de cada elemento químico
Datos de cada elemento químico En la tabla cada casillero corresponde a un elemento químico de la tabla que brinda los datos como masa atómica , la energía de ionización , el símbolo quimico , el nombre , la configuración electrónica , número atómico, electronegatividad, estados de oxidacion.
