Energía térmica - el calor
El término calor, por tanto, se debe entender como transferencia de calor y ocurre cuando hay diferencia de temperatura entre el sistema y su entorno, o entre dos zonas del sistema. Si bien las leyes o principios de la Termodinámica no establecen una dirección para el proceso, empíricamente se observa siempre que el calor fluye de la región a mayor temperatura hacia la región a menor temperatura. El flujo neto de calor entre dos sistemas a la misma temperatura es nulo, lo que se interpreta en que ambas regiones intercambian calor mutuamente con idéntica rapidez.
¿Qué es la energía térmica?
Todas las moléculas de un sistema físico se encuentran en continuo movimiento; en el caso de los sólidos se trata de una vibración en torno a una posición de equilibrio y en el de los gases es un movimiento aleatorio.
Este movimiento de las partículas tiene asociada una energía cinética, que debe clasificarse en dos tipos diferentes: la correspondiente al movimiento del sistema en su conjunto y la que corresponde al movimiento de unas partículas con respecto a otras. La suma de las energías cinéticas de todas las partículas de un cuerpo es llamada energía interna o térmica, y su aumento o disminución lo apreciaremos a través de la temperatura.
El nombre de energía térmica procede de que se puede demostrar que esta energía, tomando el valor medio por partícula, mide la temperatura ordinaria de un cuerpo, la cual no depende de que el cuerpo esté parado o en movimiento. A pesar de lo que parezca por nuestro uso cotidiano del lenguaje, los cuerpos no poseen calor ni trabajo. Tan solo tienen energía, y, al transformarse o transferirse esta, es cuando aparecen, como un estado de tránsito, el calor y el trabajo.
El calor
El calor es una forma de transferir energía entre dos cuerpos que se encuentran a diferente temperatura. El calor (Q) es una forma de energía y, por tanto, se mide en julios (J) en el SI. Otra unidad muy empleada es la caloría (cal), que se define como la cantidad de calor necesaria para elevar un grado centigrado la temperatura de un gramo de agua. La equivalencia entre ambas unidades es la siguiente:
1 cal = 4,18 J→ 1J = 0,24 cal
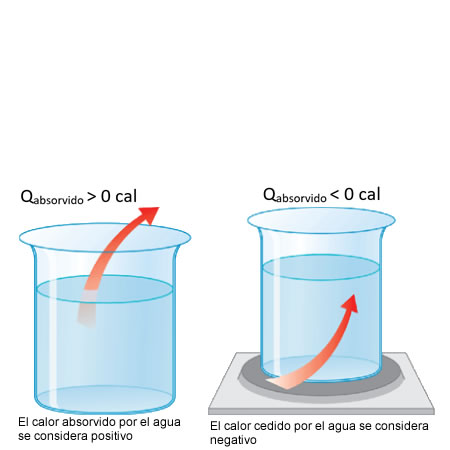
El incremento que sufre cualquier cuerpo en su temperatura (energía interna) se debe a que ha absorbido o cedido calor.
Si el cuerpo absorbe calor, esto provocará un aumento o incremento positivo de la energía interna (temperatura); entonces, el calor tendrá signo positivo. Si el cuerpo pierde energía, su incremento será negativo y, por consiguiente, también el calor.
 Intercambio de calor
Intercambio de calorPara determinar las cantidades de calor intercambiadas por un cuerpo se establece como criterio que:
- El calor es positivo (Q>0) cuando el cuerpo lo absorbe.
- El calor es negativo (Q<0) cuando el cuerpo lo cede. >/ul>
