Cambios de estado
La materia puede presentarse en diversas formas o estados. Aunque la más común en el Universo es el estado de plasma, en el que se encuentra la materia estelar, vamos a revisar los cambios entre los estados sólido, líquido y gaseoso.
Fusión y solidificación
Fusión y solidificación son procesos contrarios en el cambio de estado sólido líquido. Se producen a una temperatura determinada para cada sustancia y su valor varía muy poco con la presión.
La fusión de una sustancia supone un cambio de su estructura e interacciones entre las moléculas o unidades estructurales de la misma, y se efectúa con un aporte de calor.
Las partículas del sólido pueden vibrar. Si reciben energía, su energía cinética aumenta, y con ello también lo hace la temperatura.
Llega un momento en que el sólido se transforma en líquido. Mientras se está produciendo el cambio de estado, la temperatura no varía, porque toda la energía que absorbe el sólido se emplea en romper las fuerzas de cohesión entre las partículas, y no en aumentar su velocidad.
- Calor latente de fusión, Lf, es la cantidad de calor necesaria para que, a la temperatura de fusión y a la presión de 1 atmósfera, 1 kg de una sustancia en estado sólido se transforme en líquido.
Vaporización y licuación
Una vez completado el cambio de estado, si seguimos aportando calor, vuelve a producirse un aumento de la agitación molecular, hasta que la velocidad de las partículas es tan grande que pueden escapar de la superficie del líquido, pasando a estado gaseoso.
Vaporización es el cambio de estado de líquido a gas o vapor, también llamada ebullición. El proceso contrario se llama licuación o condensación. El proceso se efectúa a la temperatura constante de ebullición característica de cada sustancia a una determinada presión.
- Calor latente de vaporización Lv, es la cantidad de calor necesaria para que, a la temperatura de ebullición y a la presión de 1 atmósfera. 1 kg de una sustancia en estado líquido pase a vapor.
La temperatura de ebullición depende de la presión. A mayor presión exterior mayor , sera la temperatura de vaporacion y si disminuye la presión, también lo hace la temperatura del cambio de estado líquido a vapor en forma significativa.
La evaporación
El proceso por el cual un liquido pasa lentamente al estado de vapor sin que se haya alcanzado la temperatura de ebullición o vaporización a presión ordinaria, recibe el nombre de evaporación.
La explicación del proceso se hace a través de la teoría cinética de la materia, que supone que las unidades componentes de la misma están en continuo, caótico y rápido movimiento. Algunas de estas unidades (moléculas, por ejemplo) tienen la suficiente energía para vencer la atracción del resto de las moléculas y pasar a la atmósfera, o a la fase de vapor si la sustancia está en un recipiente cerrado. La tendencia a pasar a la fase de vapor aumenta con la temperatura.
La rapidez con que se efectúa el proceso depende de la superficie de evaporación, de la temperatura, de la naturaleza del líquido y, en el caso del agua, de la humedad relativa Al ser un fenómeno de superficie, resulta independiente de la masa total del liquido
Gases y vapores
Las denominaciones gas o evapors son equivalentes en cuanto al estado de agregación que describen y su diferente uso responde al hecho de que la sustancia, en condiciones ordinarias, esté en estado gaseoso (gas) o en estado líquido (vapor)
Así el agua en condiciones de presión y temperatura ordinarias, está en estado líquido y cuando se encuentra en estado gaseoso (a partir de 100 °C para la presión de una atmósfera), se denomina vapor de agua. En cambio, el butano es gaseoso a temperatura y presión ordinarias y por ello se habla de gas butano. Sin embargo, a la presión de 12 atmósferas y temperatura ordinaria, se encuentra en estado liquido (como en las garrafas que se entregan a domicilio).
Por qué se mantiene fresca el agua en una vasija de barro
Para mantener frescas las bebidas en verano el mejor método es introducirlas en una heladera o echarles cubitos de hielo. Pero hace unas décadas esto no era lo común, sobre todo en zonas rurales. Para enfriar el agua existe otro método más tradicional y que hoy se sigue empleando: la vasija de barro. ¿Cómo se mantiene fresca el agua en esta vasija! La respuesta nos la proporcionan la teoría cinética y los cambios de estado. Para explicarlo debemos saber que la superficie de la vasija es porosa. Esto quiere decir que las partículas de agua del interior pueden pasar a través de ella escapando al exterior. Y, como sabemos,
en cualquier liquido las particulas se encuentran en continuo movimiento. Además, unas particulas se mueven más rápidamente que otras. Así, las partículas de agua del interior que tienen más energía pueden llegar a escapar de la vasija. El resultado final es que permanecen en el recipiente aquellas particulas del liquido que se mueven más despacio lo que corresponde a un líquido más fresco.
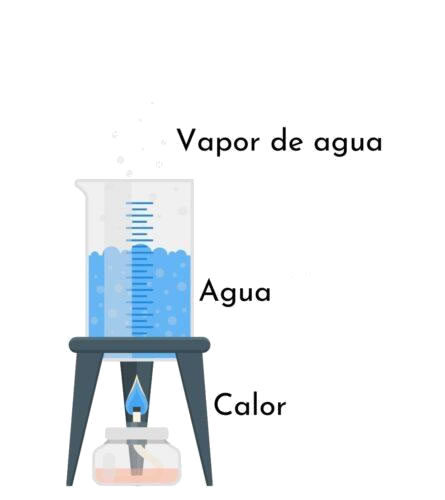 Evaporación del agua
Evaporación del aguaLa fusión de una sustancia supone un cambio de su estructura e interacciones entre las moléculas o unidades estructurales de la misma, y se efectúa con un aporte de calor. La evaporación es un proceso físico que consiste en el paso lento y gradual de un estado líquido hacia un estado gaseoso, tras haber adquirido suficiente energía para vencer a la tensión superficial. A diferencia de la ebullición, la evaporación se puede producir a cualquier temperatura, siendo más rápido cuanto más elevada sea esta. No es necesario que toda la masa alcance el punto de ebullición.
 Animación de cómo el hielo pasa a estado liquido en un recipiente. Los 50 minutos transcurridos se concentran en pocos segundos.
Animación de cómo el hielo pasa a estado liquido en un recipiente. Los 50 minutos transcurridos se concentran en pocos segundos. Según lo define el diccionario un botijo es “una vasija de barro poroso utilizada para refrescar agua”. Su funcionamiento es sencillo: el agua se filtra por los poros de la arcilla y en contacto con el ambiente exterior se evapora, produciendo un enfriamiento.
Según lo define el diccionario un botijo es “una vasija de barro poroso utilizada para refrescar agua”. Su funcionamiento es sencillo: el agua se filtra por los poros de la arcilla y en contacto con el ambiente exterior se evapora, produciendo un enfriamiento.