Intercambio de calor
El intercambio de calor es la transferencia de energía entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentran a distintas temperaturas. Este flujo siempre ocurre desde el cuerpo de mayor temperatura hacia el cuerpo de menor temperatura, ocurriendo la transferencia de calor hasta que ambos cuerpos se encuentren en equilibrio térmico. El intercambio, en física, es el proceso por el que se intercambia energía en forma de calor entre distintos cuerpos, o entre diferentes partes de un mismo cuerpo que están a distinta temperatura.
Calor específico
La capacidad calorífica específica, calor específico o capacidad térmica específica es una magnitud física que se define como la cantidad de calor que hay que suministrar a la unidad de masa de una sustancia o sistema termodinámico para elevar su temperatura en una unidad; esta se mide en varias escalas. En general, el valor del calor específico depende del valor de la temperatura inicial. Se le representa con la letra (minúscula) .
De forma análoga, se define la capacidad calorífica como la cantidad de calor que se debe suministrar a toda la masa de una sustancia para elevar su temperatura en una unidad (kelvin o grado Celsius). Se la representa con la letra (mayúscula).
En consecuencia si es necesario suministrarle la energia para que aumente su temperatura en
, la capacidad calorífica(
) se escribirá:
Generalmente esta cantidad es independiente de la temperatura y, por tanto, sele Earribia con la masa del cuerpo considerado y con la composición química El calor especifico informa sobre la mayor a menor facilidad de las sustancias para aumentar su temperatura. El calor especifico de una sustancia,ce es la cantidad de calor necesaria para elevar un grado la temperatura de un kilogramo de dicha sustancia. Se mide en Julios en el sistema internacional , pero también se puede expresar en cal. La cantidad de calor neceraria para que una masa m de una sustancia aumente su temperatura desde T1 hasta T2 se expresa entonces así:
( se es la variación de la temperatura y equivale a la temperatura final menos la tempertura inicial)
Calor latente
El calor latente es la cantidad de energía requerida por una sustancia para cambiar de fase, de sólido a líquido (calor de fusión) o de líquido a gaseoso (calor de vaporización). Se debe tener en cuenta que esta energía en forma de calor se invierte para el cambio de fase y no para un aumento de la temperatura.
En algunas circunstancias, cuando se aporta energía calorífica a un cuerpo, este no aumenta su temperatura, sino que esa energía se invierte en modificar las fuerzas que unen unas moléculas con otras, provocando que la materia cambie su estado de agregación. Los cambios de estado más corrientes son sólido líquido y líquido → gas. Los cambios sólido → gas son más raros y, en general, se producen en circunstancias no ordinarias. Los cambios de estado se caracterizan por lo siguiente:
- No cambian la naturaleza de la sustancia.
- Se producen a temperatura constante para cada presión.
- La sustancia absorbe o cede calor. El calor invertido en el proceso para la unidad de masa recibe el nombre de calor latente de cambio de estado.
- El valor de la temperatura a la que se producen y el valor del calor latente correspondiente son característicos de cada cambio de estado y de la naturaleza de la sustancia.
Q = m · L
Donde m es la masa de la sustancia considerada y L es una propiedad característica de cada sustancia, llamada calor latente. El calor latente se mide en J/kg en unidades del Sl. La representación gráfica de la temperatura de un sistema físico en función del tiempo, cuando el sistema absorbe o libera un calor constante por unidad de tiempo, se llama gráfica de calentamiento o enfriamiento.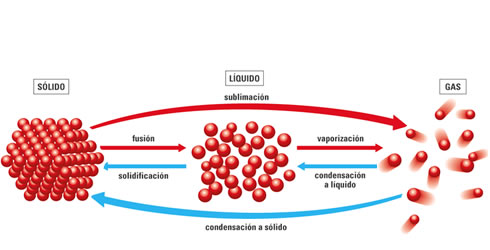 El calor y los cambios de estado
El calor y los cambios de estadoLa materia se encuentra habitualmente en tres estados de agregación: el sólido, el líquido y el gaseoso. Una misma sustancia aparece en uno u otro estado en función de las condiciones de presión y temperatura a las que se encuentre sometida, por lo que mediante la variación de estas se puede conseguir la transformación entre dos estados diferentes.
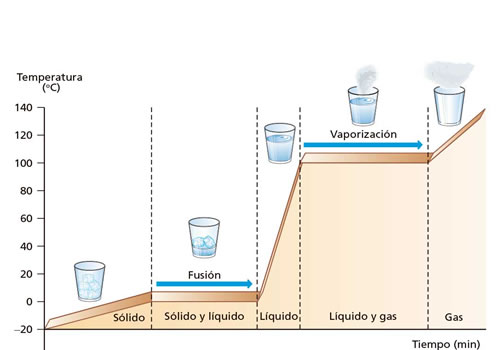 Cambios dek estado de agua
Cambios dek estado de aguaCurva de calentamiento del agua , los tramos horizontales corresponden al intervalo de tiempo en los que la temperatura del sistema físico permanece constante.
